آزماش Anti-Endomysial Antibody (EMA) | آنتی بادی ضد اندومیزیال | بیماری سلیاک
- چرا آزمایش Anti-Endomysial Antibody (EMA) درخواست می شود؟
- چه زمانی آزمایش Anti-Endomysial Antibody (EMA) بایستی انجام شود؟
- نمونه مورد نیاز برای آزمایش Anti-Endomysial Antibody (EMA):
- آمادگی قبل از انجام آزمایش Anti-Endomysial Antibody (EMA):
- روش های مختلف انجام آزمایش Anti-Endomysial Antibody (EMA):
- چه چیزی در آزمایش Anti-Endomysial Antibody (EMA) مورد بررسی قرار می گیرد؟
- سوالات متداول
- علائم بیماری سلیاک شامل چه مواردی است؟
- به جز EMA سایر آنتی بادی های مرتبط با بیماری سلیاک کدامند؟
- آزمایش آنتی بادی های بیماری سلیاک | آنتی بادی ترانس گلوتامیناز بافتی (TTG) | آنتی بادی های پپتیدی گلیادین دآمینه شده (DGP) | آنتی بادی های ضد اندومیزیال (EMA) | آنتی بادی های ضد رتیکولین (ARA) | ایمونوگلوبولین A (IgA)
- آزمایش آنتی گلیادین | Anti Gliadin | آنتی بادی های پپتیدی گلیادین دآمیده شده (DGP) | Deaminated Gliadin Peptide Antibodies
- عوامل خطر برای بیماری سلیاک شامل چه مواردی است؟
- بیماری سلیاک چه تفاوتی با حساسیت به گلوتن دارد؟
- بیماری سلیاک در چه سن هایی شیوع بیشتری دارد؟
- آیا بیماری سلیاک وابستگی به جنس دارد؟
- شایع ترین علائم بیماری سلیاک چیست؟
- آزمایش EMA چه تفاوتی با آزمایش آنتی بادی ضد ترانس گلوتامیناز بافتی (tTG) دارد؟
- چه عواملی می تواند منجر به نتایج مثبت کاذب یا منفی کاذب تست EMA شود؟
- آیا نتیجه مثبت تست EMA برای تشخیص بیماری سلیاک کافی است یا آزمایشات تکمیلی لازم است؟
- مطالب مرتبط در متااورگانون:
- الگوریتم تشخیصی بیماری سلیاک | Diagnostic algorithm of celiac disease
- آزمایش آنتی بادی های ضد ساکارومایسس سرویزیه (ASCA) | Anti-Saccharomyces cerevisiae Antibodies
- آزمایش آنتی بادی ماهیچه صاف (SMA) و آنتی بادی F-اکتین (F-Actin) | Anti Smooth Muscle Antibody
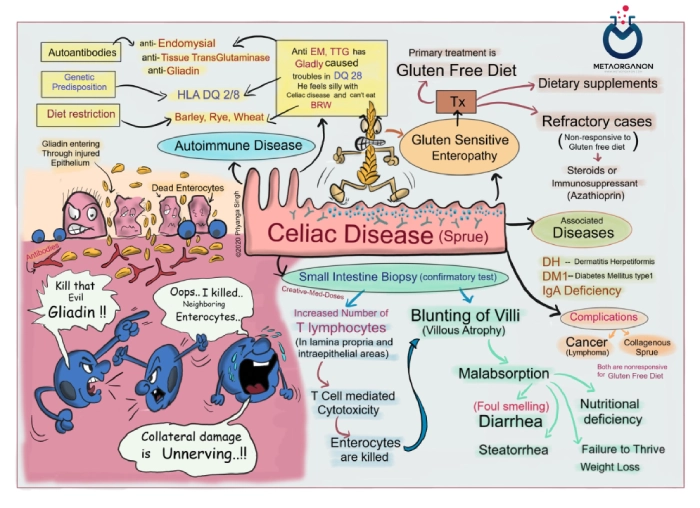
Anti-Endomysial Antibody (EMA) یا آنتی بادی های ضد اندومیزیال اتوآنتی بادی هایی هستند که با برخی شرایط خود ایمنی، به ویژه بیماری سلیاک مرتبط هستند. این آنتی بادی ها اندومیزیوم را هدف قرار می دهند که لایه ای از بافت همبند است که رشته های عضلانی را احاطه کرده است. این آنتی بادی ها در واکنش به آسیب مداوم به دیواره روده ایجاد می شوند.
اسامی دیگر:
- Anti-Endomysial Antibody
- Anti endomysial Antibody
- Anti mesothelial Antibody
- Celiac Disease
- Coeliac Disease
- Cutaneous Immunofluorescence
- Dermatitis herpetiformis
- Dermato immuno pathology
- Failure to Thrive
- Gluten-sensitive Enteropathy
- Immuno dermatology
- Immunofluorescence Antibodies
- Immunopathology
- Malabsorption
- Sprue
- Celiac Disease (order DGLDN, RTA, EMA)
چرا آزمایش Anti-Endomysial Antibody (EMA) درخواست می شود؟
آزمایش Anti-Endomysial Antibody (EMA) اغلب برای تشخیص و مانیتور بیماری سلیاک درخواست می شود:
- تشخیص بیماری سلیاک: آزمایش EMA در درجه اول برای تشخیص بیماری سلیاک، که یک وضعیت خود ایمنی است که با مصرف گلوتن در افراد مستعد ژنتیکی ایجاد می شود، استفاده می شود. هنگامی که گلوتن مصرف می شود، می تواند منجر به آسیب به پوشش روده کوچک شود. EMA یکی از اتوآنتی بادی های خاصی است که سیستم ایمنی در پاسخ به این آسیب تولید می کند. تشخیص EMA در خون بیمار یک نشانگر تشخیصی مهم برای بیماری سلیاک است.
- تأیید بیماری سلیاک: آزمایش EMA اغلب برای تایید تشخیص بیماری سلیاک استفاده می شود، زمانی که نشانگرهای سرولوژیکی دیگر، مانند آنتی بادی های ضد ترانس گلوتامیناز بافتی یا آنتی بادی های ضد گلیادین، نتایج مثبتی را نشان می دهند. وجود EMA، به ویژه هنگام استفاده از تکنیک های ایمونوفلورسانس غیرمستقیم، برای بیماری سلیاک بسیار اختصاصی در نظر گرفته می شود.
- نظارت بر بیماری سلیاک: علاوه بر تشخیص اولیه، آزمایش EMA می تواند برای نظارت بر پیشرفت بیماری سلیاک در افرادی که تشخیص داده شده اند، استفاده شود. این امر به ویژه برای ارزیابی اثربخشی رژیم غذایی بدون گلوتن و بهبود پوشش روده کوچک مهم است. کاهش یا عادی شدن سطوح EMA در طول زمان ممکن است نشان دهنده بهبود باشد.
- غربالگری برای جمعیت های در معرض خطر: آزمایش EMA ممکن است برای غربالگری افراد در معرض خطر بالای بیماری سلیاک، مانند اعضای خانواده افراد مبتلا به بیماری سلیاک، افراد دارای شرایط خودایمنی خاص، و افرادی که دارای استعداد ژنتیکی هستند، استفاده شود. . غربالگری می تواند به شناسایی موارد بالقوه بیماری سلیاک در مراحل اولیه کمک کند.
تصمیم برای درخواست آزمایش EMA معمولاً بر اساس علائم بالینی، عوامل خطر و سایر اطلاعات تشخیصی است و باید توسط یک پزشک معالج مانند یک متخصص گوارش با مشورت یک آزمایشگاه بالینی گرفته شود.
چه زمانی آزمایش Anti-Endomysial Antibody (EMA) بایستی انجام شود؟
آزمایش Anti-Endomysial Antibody (EMA) معمولاً در سناریوهای زیر در نظر گرفته میشود که علائم و عوامل خطر خاصی احتمال ابتلا به بیماری سلیاک را نشان دهند:
- علائم گوارشی: بیماری سلیاک اغلب با طیفی از علائم گوارشی از جمله اسهال مزمن، درد شکم، نفخ و کاهش وزن غیرقابل توضیح همراه است. اگر بیمار با مشکلات گوارشی مداوم یا مکرر مراجعه کند، به ویژه در صورت عدم وجود علت واضح دیگر، ممکن است بیماری سلیاک در نظر گرفته شود و آزمایش EMA می تواند مناسب باشد.
- علائم سوء جذب: بیماری سلیاک می تواند منجر به سوء جذب مواد مغذی ضروری شود و در نتیجه علائمی مانند کمبود ویتامین، کم خونی و پوکی استخوان را به همراه داشته باشد. اگر بیمار علائم سوء جذب، از جمله خستگی، ضعف، یا مشکلات سلامت استخوان را نشان دهد، ممکن است آزمایش EMA توصیه شود.
- علائم پوستی: برخی از افراد مبتلا به بیماری سلیاک ممکن است تظاهرات پوستی مانند درماتیت هرپتی فرمیس، یک بیماری پوستی تاول زا را داشته باشند. بثورات پوستی یا مشکلات پوستی غیر قابل توضیح می تواند دلیلی برای بررسی آزمایش EMA باشد.
- سابقه خانوادگی: داشتن سابقه خانوادگی بیماری سلیاک یک عامل خطر مهم است. اگر یکی از بستگان نزدیک (والدین، خواهر و برادر یا فرزند) مبتلا به بیماری سلیاک تشخیص داده شده باشد، افراد دارای استعداد ژنتیکی ممکن است برای آزمایش EMA در نظر گرفته شوند، به خصوص اگر علائم مرتبط را تجربه کنند.
- شرایط مرتبط: بیماری سلیاک با برخی شرایط خودایمنی مانند دیابت نوع 1، بیماری های خودایمنی تیروئید (مانند تیروئیدیت هاشیموتو و بیماری گریوز) و بیماری های خودایمنی کبد شناخته شده است. اگر فردی دارای یکی از این شرایط خودایمنی باشد، ممکن است در معرض خطر ابتلا به بیماری سلیاک باشد و آزمایش EMA ممکن است بخشی از ارزیابی تشخیصی باشد.
- ناباروری یا مشکلات باروری غیر قابل توضیح: بیماری سلیاک در برخی موارد با مشکلات تولید مثل مرتبط است. افرادی که ناباروری غیرقابل توضیح یا سقطهای مکرر را تجربه میکنند ممکن است برای بررسی احتمال بیماری سلیاک تحت آزمایش EMA قرار گیرند.
- علائم غیر گوارشی: بیماری سلیاک می تواند با طیف وسیعی از علائم غیر گوارشی، از جمله سردرد، درد مفاصل، علائم عصبی و اختلالات خلقی ظاهر شود. اگر فردی چنین علائمی داشته باشد و سایر علل بالقوه رد شده باشد، ممکن است آزمایش EMA در نظر گرفته شود.
توجه به این نکته مهم است که تصمیم برای انجام آزمایش EMA باید توسط یک ارائه دهنده مراقبت های بهداشتی، معمولاً یک متخصص گوارش بر اساس یک ارزیابی بالینی کامل، از جمله بررسی علائم، تاریخچه پزشکی و عوامل خطر مرتبط گرفته شود. علاوه بر این، سایر آزمایشهای سرولوژیکی، مانند آنتیبادیهای ضد ترانس گلوتامیناز بافتی و آنتیبادیهای ضد گلیادین نیز ممکن است همراه با آزمایش EMA برای ارزیابی جامع بیماری سلیاک استفاده شوند.
نمونه مورد نیاز برای آزمایش Anti-Endomysial Antibody (EMA):
- ظرف/لوله: لوله با درب قرمز یا زرد (ترجیحا همراه با ژل جداکننده)
- نوع نمونه: سرم
- حجم نمونه: 0/5 میلی لیتر
شاید این مطلب برای شما مفید باشد:
روش های مختلف جمع آوری نمونه های آزمایشگاه
شاید این مطلب برای شما مفید باشد:
لوله های آزمایش و ضد انعقادها (Test tubes and Anticoagulants)
شاید این مطلب برای شما مفید باشد:
ذخیره سازی نمونه های آزمایشگاهی
آمادگی قبل از انجام آزمایش Anti-Endomysial Antibody (EMA):
به آمادگی خاصی نیاز ندارد
روش های مختلف انجام آزمایش Anti-Endomysial Antibody (EMA):
روش ایمونوفلورسانس غیر مستقیم (IFA):
انجام آزمایش آنتی بادی آنتی اندومیزیال (EMA) با استفاده از روش ایمونوفلورسانس غیر مستقیم (IFA) شامل چندین مرحله است. در اینجا یک مرور کلی از نحوه انجام این آزمون آورده شده است:
- تهیه نمونه: نمونه سرم بیمار را با جمع آوری آن طبق روش های استاندارد آزمایشگاهی آماده کنید. بخش های بافت را روی اسلایدهای شیشه ای آماده کنید. این مقاطع باید نازک و دارای ضخامت یکنواخت باشند.
- رقیق سازی سرم بیمار: سرم بیمار معمولاً در بافر رقت سرم رقیق می شود تا رنگ پس زمینه کاهش یابد. رقتهای مختلفی ممکن است مورد آزمایش قرار گیرند و رعایت پروتکلهای خاص آزمایشگاه برای رقتسازی سرم ضروری است.
- اضافه کردن سرم: سرم رقیق شده بیمار را روی بخش های بافتی روی لام های شیشه ای اضافه کنید. هر رقت در یک اسلاید جداگانه آزمایش می شود. اسلایدها را در یک محفظه انکوباسیون قرار دهید تا آنتی بادی های موجود در سرم به اندومیزیوم در بافت متصل شوند.
- شستشو: پس از انکوباسیون، لام ها را با سالین بافر فسفات (PBS) بشویید تا آنتی بادی های متصل نشده حذف شوند.
- اضافه کردن آنتی بادی ثانویه: ایمونوگلوبولین ضد انسانی (معمولا IgA) با برچسب فلورسنت را روی بخش های بافتی بمالید. این آنتی بادی ثانویه به هر آنتی بادی (EMA) که به اندومیزیوم متصل شده است متصل می شود.
- شستشو: لام ها را مجدداً با PBS بشویید تا هر گونه آنتی بادی ثانویه غیرمجاز حذف شود.
- بررسی میکروسکوپی: اسلایدها را زیر میکروسکوپ فلورسانس بررسی کنید. به دنبال الگوهای فلورسنت مشخصه باشید، که معمولاً به صورت یک الگوی “chicken-wire” یا مشبک ظاهر می شوند. این الگو نشان دهنده نتیجه مثبت تست EMA است.
- تفسیر: یک نتیجه مثبت EMA بر اساس وجود الگوی مشخصه زیر میکروسکوپ است. عدم وجود این الگو یک نتیجه منفی در نظر گرفته می شود.

الگوهای فلورسنت مثبت برای آزمایش Anti-Endomysial Antibody (EMA)
توجه به این نکته ضروری است که تست EMA زمانی که به درستی انجام شود بسیار حساس و خاص است. آزمایشگاه ها باید از رویه های استاندارد و کنترل کیفیت برای اطمینان از اعتبار نتایج پیروی کنند. تفسیر الگوهای فلورسنت باید توسط پرسنل مجرب آزمایشگاه انجام شود تا از مثبت یا منفی کاذب جلوگیری شود.
روش ایمونوسوربنت متصل با آنزیم (ELISA):
ELISA برای انجام آزمایش آنتی بادی آنتی اندومیزیال (EMA) جایگزینی برای روش سنتی ایمونوفلورسانس غیر مستقیم (IFA) است. الایزا روشی خودکارتر و کم کارتر است. در اینجا شرح مفصلی از نحوه انجام روش ELISA برای آزمایش EMA آورده شده است:
- تهیه نمونه: نمونه سرم بیمار را طبق روش های استاندارد آزمایشگاهی آماده کنید. اطمینان حاصل کنید که صفحات میکروتیتر با آنتی ژن EMA پوشانده شده اند. آنتی ژن باید روی چاهک های صفحه ثابت باشد.
- رقیق سازی سرم بیمار: سرم بیمار معمولاً در بافر رقت سرم رقیق می شود تا تداخل پس زمینه کاهش یابد. فاکتورهای رقت خاص ممکن است متفاوت باشد و باید از پروتکل آزمایشگاه پیروی کرد.
- اضافه کردن سرم: سرم رقیق شده بیمار را به چاهک های پلیت میکروتیتر پوشش داده شده اضافه کنید. هر رقت در چاهک های جداگانه آزمایش می شود.
- انکوباسیون: پلیت را در یک اتوکلاو جهت انکوباسیون قرار دهید تا آنتی بادی های موجود در سرم بیمار به آنتی ژن EMA روی پلیت متصل شوند.
- شستشو: پس از انکوباسیون، چاهک های پلیت را با یک بافر شستشو بشویید تا آنتی بادی های متصل نشده حذف شوند.
- اضافه کردن آنتی بادی ثانویه: آنتی بادی ثانویه کونژوگه با آنزیم (ایمونوگلوبولین ضد انسانی، معمولاً IgA) را به چاهک های صفحه اضافه کنید. این آنتی بادی ثانویه به هر آنتی بادی EMA که به آنتی ژن در چاهک ها متصل شده است متصل می شود.
- انکوباسیون: دوباره پلیت را انکوبه کنید تا آنتی بادی ثانویه به آنتی بادی های EMA متصل شود.
- شستشو: چاهک های صفحه را یک بار دیگر بشویید تا آنتی بادی های ثانویه غیرمجاز حذف شوند.
- افزودن سوبسترا: محلول سوبسترا (به عنوان مثال، TMB) را به چاهک های صفحه اضافه کنید. آنتی بادی ثانویه کونژوگه با آنزیم هنگامی که با سوبسترا تعامل می کند باعث تغییر رنگ می شود.
- انکوباسیون: پلیت را برای مدت زمان مشخصی انکوبه کنید تا تغییر رنگ رخ دهد. مدت زمان ممکن است بسته به پروتکل آزمایشگاه متفاوت باشد.
- محلول توقف: برای متوقف کردن واکنش آنزیمی، یک محلول توقف (به عنوان مثال، اسید سولفوریک) اضافه کنید. این رشد رنگ را متوقف می کند.
- اندازه گیری: برای اندازه گیری چگالی نوری (OD) چاهک ها از صفحه خوان یا اسپکتروفتومتر استفاده کنید. OD با غلظت آنتی بادی های EMA در سرم بیمار نسبت مستقیم دارد.
- تفسیر: نتایج با مقایسه OD نمونه بیمار با کنترل استاندارد تعیین می شود. OD بالاتر نشان دهنده وجود آنتی بادی های EMA است، در حالی که OD کمتر نشان دهنده عدم وجود آنها است.
- مستندات: نتایج را ثبت و گزارش کنید، از جمله مقادیر OD، ضریب رقت، و هر مقدار کنترل مربوطه.
- کنترل کیفیت: اطمینان حاصل کنید که اقدامات کنترل کیفیت برای حفظ دقت و قابلیت اطمینان تست انجام شده است.
ELISA مزیت اتوماسیون را ارائه می دهد و آن را برای آزمایش های با توان بالا در آزمایشگاه های بالینی مناسب می کند. تفسیر بر اساس تغییر رنگ است و نسبت به روش IFA کمتر دچار اشتباهات تفسیری می شود. با این حال، مانند هر آزمایش آزمایشگاهی، رعایت روش های استاندارد و کنترل کیفیت برای نتایج دقیق ضروری است.
چه چیزی در آزمایش Anti-Endomysial Antibody (EMA) مورد بررسی قرار می گیرد؟
اندومیزیوم جزء حیاتی بدن انسان است که نقش مهمی در سلامت و بیماری دارد. در زمینه علم پزشکی، اصطلاح “اندومیزیال” اغلب با نوع خاصی از آنتی بادی به نام آنتی بادی ضد اندومیزیال (EMA) مرتبط است. این آنتی بادی ها در تشخیص بیماری سلیاک، یک اختلال خود ایمنی که در اثر مصرف گلوتن ایجاد می شود، اهمیت زیادی دارند.
ساختار و عملکرد اندومیزیوم (Endomysium):
اندومیزیوم (endomysium) یک لایه نازک در ساختار بافت همبند در عضلات اسکلتی است. نقش مهمی در حمایت ساختاری از فیبرهای عضلانی و تسهیل عملکرد عضلات دارد. اندومیزیوم داخلی ترین لایه بافت همبند در سازماندهی عضلات اسکلتی است.
ساختار آن به شرح زیر است:
اندومیزیوم در درجه اول از رشته های کلاژن تشکیل شده است که قوی و انعطاف پذیر هستند. این رشته های کلاژن یک شبکه ظریف و مشبک را تشکیل می دهند که تک تک فیبرهای عضلانی (سلول های عضلانی) را احاطه کرده است. این شبکه برای عملکرد صحیح عضلات ضروری است. داخل فاسیکل عضلانی قرار دارد که دسته ای از فیبرهای عضلانی است. اندومیزیوم فیبرهای عضلانی منفرد را در یک فاسیکل احاطه کرده و از یکدیگر جدا می کند.
اندومیزیوم (endomysium) بسیار نازک است و از شبکه ظریفی از رشته های کلاژن تشکیل شده است که هر فیبر عضلانی را در بر می گیرد. ماهیت نازک آن اجازه می دهد تا فیبرهای عضلانی در یک فاسیکل نزدیک شوند.

ساختار اندومیزیوم (Endomysium)
عملکرد اندومیزیوم (endomysium):
اندومیزیوم چندین عملکرد حیاتی را در زمینه عضلات اسکلتی انجام می دهد:
- حمایت ساختاری: یکی از عملکردهای اولیه اندومیزیوم، حمایت ساختاری از فیبرهای عضلانی است. این به حفظ یکپارچگی و شکل هر فیبر عضلانی در طول انقباض و آرامش عضلات کمک می کند. بدون این حمایت، فیبرهای عضلانی ممکن است در طول انقباض به هم ریخته و منجر به ناکارآمدی و آسیب احتمالی شود.
- جداسازی فیبرهای عضلانی: شبکه کلاژن اندومیزیوم هر فیبر عضلانی را از رشته های همسایه خود در یک فاسیکل جدا می کند. این جداسازی به فیبرهای عضلانی اجازه می دهد تا به طور مستقل و بدون تداخل با یکدیگر منقبض شوند. همچنین به توزیع یکنواخت نیروهای ایجاد شده در طول انقباضات عضلانی کمک می کند.
- عروق و تامین اعصاب: اندومیزیوم رگ های خونی و رشته های عصبی را در خود جای می دهد که مواد مغذی و اکسیژن را به فیبرهای عضلانی می رسانند. این رگ های خونی و اعصاب در داخل شبکه کلاژن قرار دارند و تضمین می کنند که هر فیبر عضلانی منابع لازم برای تولید انرژی و هماهنگی را دریافت می کند.
- محافظت: اندومیزیوم به عنوان یک مانع محافظ در اطراف فیبرهای عضلانی فردی عمل می کند و از آنها در برابر استرس مکانیکی خارجی و آسیب احتمالی محافظت می کند. این به جلوگیری از آسیب دیدن فیبرهای عضلانی در حین فعالیت بدنی کمک می کند.
- انتقال نیروهای انقباضی: اندومیزیوم به انتقال نیروهای انقباضی تولید شده توسط فیبرهای عضلانی منفرد کمک می کند. این نیروها به پریمیزیوم و اپیمیزیم که لایه های ضخیم تری از بافت همبند هستند که به ترتیب بسته های بزرگتری از رشته های عضلانی و کل ماهیچه ها را احاطه کرده اند، منتقل می شوند.
بیماری سلیاک و نقش آنتی بادی های اندومیزیال یا Anti-Endomysial Antibody (EMA):
بیماری سلیاک یک اختلال خود ایمنی است که روده کوچک را تحت تاثیر قرار می دهد و با مصرف گلوتن، پروتئینی که در گندم، جو و چاودار یافت می شود، ایجاد می شود. نقش آنتی بادی ضد اندومیزیال (EMA) در بیماری سلیاک بسیار مهم است، زیرا این آنتی بادی ها نقش مهمی در تشخیص و درک این بیماری دارند.
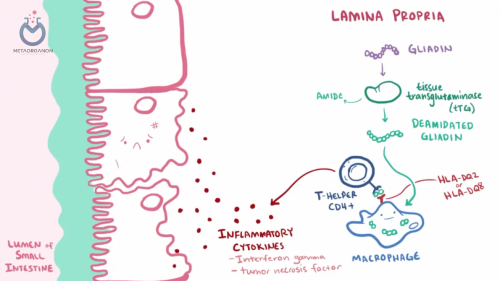
- بیماری سلیاک با پاسخ ایمنی غیر طبیعی به گلوتن مشخص می شود. در افراد دارای استعداد ژنتیکی (معمولاً دارای انواع خاصی از ژن HLA-DQ)، مصرف گلوتن منجر به واکنش خود ایمنی می شود.
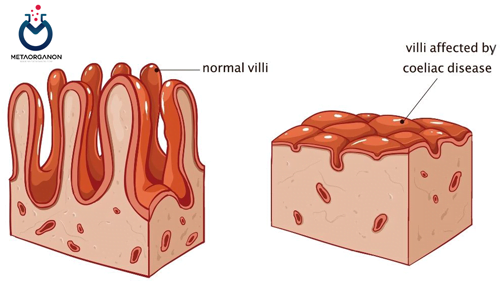
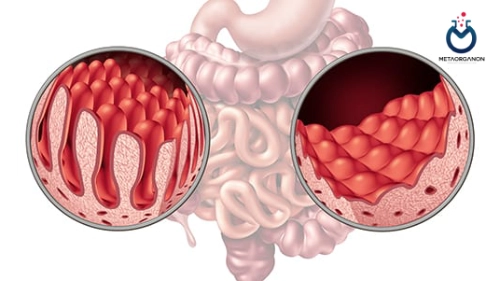
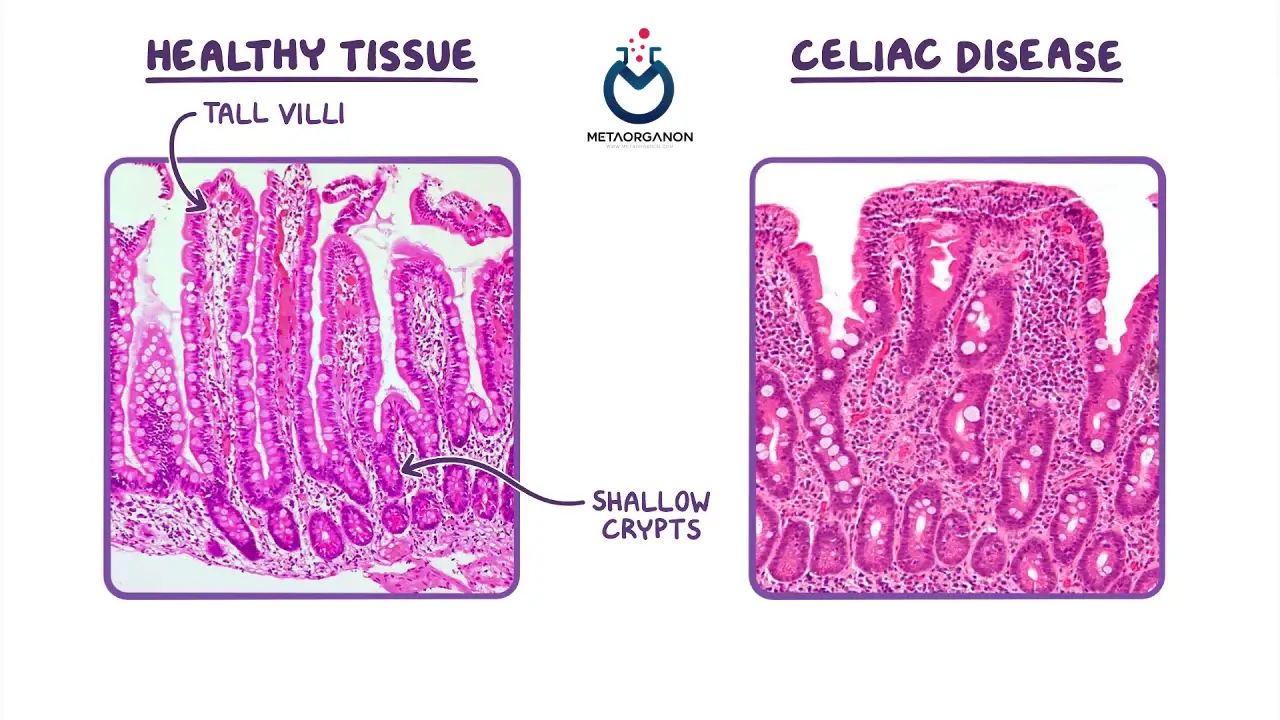
- سیستم ایمنی به اشتباه پوشش داخلی روده کوچک، به ویژه پرزها را هدف قرار می دهد و به آن آسیب می رساند، که برآمدگی های انگشت مانندی هستند که به جذب مواد مغذی کمک می کنند.
- این واکنش خودایمنی منجر به علائم مختلف گوارشی و سیستمیک مانند اسهال، درد شکم، نفخ، خستگی و درماتیت هرپتی فرمیس (بثورات پوستی) می شود.
- تشخیص بیماری سلیاک به دلیل علائم متنوع و اغلب غیر اختصاصی آن می تواند چالش برانگیز باشد. بنابراین، ارائه دهندگان مراقبت های بهداشتی به ترکیبی از ارزیابی بالینی، آزمایش های سرولوژیکی و معاینه آندوسکوپی روده کوچک برای ایجاد تشخیص تکیه می کنند.
- EMA یکی از آنتی بادی های اختصاصی است که توسط سیستم ایمنی در پاسخ به آسیب های ناشی از مصرف گلوتن تولید می شود. این آنتی بادی ها اندومیزیوم را هدف قرار می دهند که یک لایه بافت همبند است که فیبرهای عضلانی منفرد را در بدن احاطه کرده است.
- EMA برای بیماری سلیاک بسیار اختصاصی است. وجود آن در سرم بیمار نشان دهنده پاسخ خود ایمنی ناشی از مصرف گلوتن و آسیب ناشی از اندومیزیوم در روده کوچک است.
- آزمایش EMA معمولاً با استفاده از تکنیکهایی مانند ایمونوفلورسانس غیرمستقیم انجام میشود که در آن سرم بیمار روی بخشهایی از مری میمون یا بافت بند ناف انسان اعمال میشود. وجود آنتی بادی های EMA زمانی تایید می شود که یک الگوی فلورسنت مشخصه (الگوی شبکه ای) در زیر میکروسکوپ مشاهده شود.
- نتیجه مثبت تست EMA، هنگامی که با علائم بالینی و سایر نشانگرهای سرولوژیکی ترکیب شود، به شدت از تشخیص بیماری سلیاک حمایت می کند. به ویژه در مواردی که سایر آزمایشها، مانند آنتیبادیهای ضد ترانس گلوتامیناز بافتی و آنتیبادیهای ضد گلیادین، نتایج واضحی ارائه نمیدهند، ارزشمند است.
آنتیبادیهای اندومیزیال IgG و IgA در گردش در 70 تا 80 درصد بیماران مبتلا به درماتیت هرپتیفورمیس یا بیماری سلیاک و تقریباً در تمام این بیماران که انتروپاتی حساس به گلوتن درجه بالایی دارند و از رژیم غذایی بدون گلوتن پیروی نمیکنند، وجود دارد.
به دلیل ویژگی بالای آنتی بادی های اندومیزیال برای بیماری سلیاک، این آزمایش ممکن است نیاز به بیوپسی های متعدد روده کوچک را برای تأیید تشخیص برطرف کند. این ممکن است به ویژه در جمعیت اطفال مفید باشد، از جمله ارزیابی کودکان مبتلا به ناتوانی در رشد.
سوالات متداول
علائم بیماری سلیاک شامل چه مواردی است؟
علائم بیماری سلیاک عبارتند از:
- شکم درد و نفخ مکرر
- اسهال مزمن
- یبوست
- مدفوع رنگ پریده، بدبو یا چرب
- گاز روده بیش از حد
- کاهش وزن
- زخم های دهان (زخم)
- خستگی شدید (خستگی)
- کم خونی
- اختلالات خلقی، از جمله افسردگی
- تشنج
- بثورات پوستی خارش دار
- درد استخوان و مفاصل
در کودکان، علائم ممکن است شامل موارد زیر نیز باشد:
- مدفوع چرب و رنگ روشن
- استفراغ
- تحریک پذیری یا تغییر در خلق و خو
- رشد آهسته
- کاهش وزن
- مشکلات مینای دندان در دندان های بزرگسال (دائمی)
به جز EMA سایر آنتی بادی های مرتبط با بیماری سلیاک کدامند؟
علاوه بر آنتی بادی های ضد اندومیزیال (EMA)، چندین آنتی بادی دیگر نیز با بیماری سلیاک مرتبط هستند. این آنتی بادی ها نقش مهمی در تشخیص و درک این بیماری دارند. در اینجا برخی از آنتی بادی های اولیه مربوط به بیماری سلیاک آورده شده است:
- آنتی بادی های ضد ترانس گلوتامیناز بافتی (tTG-IgA و tTG-IgG): آنتی بادی های ضد ترانس گلوتامیناز بافتی معمولاً در تشخیص سرولوژیکی بیماری سلیاک استفاده می شوند. آنها به دو شکل وجود دارند: IgA و IgG. tTG-IgA آزمایش اولیه ای است که در افراد با سطوح IgA طبیعی استفاده می شود، در حالی که tTG-IgG زمانی که کمبود IgA وجود دارد استفاده می شود.
- آنتی بادی های پپتید گلیادین ضد دآمید شده (DGP-IgA و DGP-IgG): این آنتی بادی ها پپتیدهای گلیادین دآمید شده را که قطعاتی از گلوتن هستند هدف قرار می دهند. آنتی بادی های DGP در تشخیص بیماری سلیاک مفید هستند، به ویژه زمانی که افراد دچار کمبود IgA هستند.
- آنتی بادی های ضد گلیادین (AGA-IgA و AGA-IgG): آنتی بادی های ضد گلیادین جزء گلیادین گلوتن را هدف قرار می دهند. در حالی که قبلاً در تشخیص بیماری سلیاک استفاده میشد، نسبت به سایر آنتیبادیها اختصاصیتر هستند و تا حد زیادی با آزمایشهای قابل اعتمادتری مانند آنتیبادیهای tTG و DGP جایگزین شدهاند.
- آنتی بادی های ضد رتیکولین (ARA): آنتی بادی های آنتی رتیکولین در گذشته برای تشخیص بیماری سلیاک استفاده می شد اما به دلیل ویژگی کمتر در مقایسه با سایر آنتی بادی ها، دیگر معمولاً مورد استفاده قرار نمی گیرند.
- آنتی بادی های ضد اکتین: این آنتی بادی ها اکتین، پروتئین موجود در ماهیچه صاف را هدف قرار می دهند. آنها قبلاً در تشخیص بیماری سلیاک در نظر گرفته می شدند، اما استفاده از آنها به نفع آزمایش های خاص تر کاهش یافته است.
توجه به این نکته مهم است که در حالی که آزمایشهای سرولوژیکی برای این آنتیبادیها ابزار ارزشمندی برای تشخیص بیماری سلیاک هستند، تشخیص نهایی اغلب شامل ترکیبی از ارزیابی بالینی، آزمایش آنتیبادی، و در برخی موارد، بیوپسی تأییدی روده کوچک است. این آزمایش ها برای ارزیابی پاسخ خود ایمنی و میزان آسیب روده کوچک ناشی از مصرف گلوتن در افراد مبتلا به بیماری سلیاک استفاده می شود.
شاید این مطلب برای شما مفید باشد:
آزمایش آنتی بادی های بیماری سلیاک | آنتی بادی ترانس گلوتامیناز بافتی (TTG) | آنتی بادی های پپتیدی گلیادین دآمینه شده (DGP) | آنتی بادی های ضد اندومیزیال (EMA) | آنتی بادی های ضد رتیکولین (ARA) | ایمونوگلوبولین A (IgA)
شاید این مطلب برای شما مفید باشد:
آزمایش آنتی گلیادین | Anti Gliadin | آنتی بادی های پپتیدی گلیادین دآمیده شده (DGP) | Deaminated Gliadin Peptide Antibodies
عوامل خطر برای بیماری سلیاک شامل چه مواردی است؟
بیماری سلیاک یک بیماری خودایمنی است و در حالی که میتواند افراد را بدون هیچ عامل خطر خاصی تحت تاثیر قرار دهد، عوامل متعددی وجود دارند که میتوانند احتمال ابتلا به این بیماری را افزایش دهند. در اینجا برخی از عوامل خطر کلیدی برای بیماری سلیاک آورده شده است:
- سابقه خانوادگی: داشتن یکی از بستگان درجه یک (والدین، خواهر و برادر یا فرزند) مبتلا به بیماری سلیاک به طور قابل توجهی این خطر را افزایش می دهد. مؤلفه ژنتیکی نقش مهمی در پیشرفت این بیماری دارد و افراد دارای بستگان نزدیک مبتلا به بیماری سلیاک در معرض خطر بیشتری هستند.
- استعداد ژنتیکی: وجود گونه های خاص ژن HLA-DQ، به ویژه HLA-DQ2 و HLA-DQ8، به شدت با افزایش خطر بیماری سلیاک مرتبط است. این ژن ها بخش مهمی از حساسیت ژنتیکی به این بیماری هستند.
- سایر بیماری های خودایمنی: افراد مبتلا به سایر بیماری های خودایمنی، مانند دیابت نوع 1، بیماری خودایمنی تیروئید (تیروئیدیت هاشیموتو و بیماری گریوز) و بیماری های کبدی خود ایمنی (مانند هپاتیت خود ایمنی)، در معرض خطر بالایی هستند. بیماری سلیاک رابطه بین این شرایط به طور کامل درک نشده است، اما اعتقاد بر این است که مکانیسم های خودایمنی مشترک را شامل می شود.
- عفونت های گوارشی: برخی از مطالعات نشان داده اند که عفونت های گوارشی در اوایل دوران کودکی ممکن است خطر ابتلا به بیماری سلیاک را افزایش دهد. تصور میشود که عفونتها ممکن است باعث ایجاد پاسخ خودایمنی در برابر گلوتن در افراد مستعد ژنتیکی شوند.
- تأخیر در معرفی گلوتن: شواهدی وجود دارد که نشان می دهد تاخیر در معرفی غذاهای حاوی گلوتن به رژیم غذایی نوزاد بیش از شش ماهگی ممکن است با افزایش خطر ابتلا به بیماری سلیاک مرتبط باشد. زمان دقیق و تأثیر آن هنوز موضوع تحقیق است.
- عوامل محیطی: عواملی مانند مواجهه زودهنگام با گلوتن، نوع تغذیه نوزاد (تغذیه با شیر مادر در مقابل شیر خشک)، و زمان تزریق گلوتن در دوران نوزادی ممکن است بر خطر ابتلا به بیماری سلیاک تأثیر بگذارد. با این حال، تأثیر متقابل این عوامل با ژنتیک پیچیده است و به طور کامل درک نشده است.
- قومیت و جغرافیا: بیماری سلیاک می تواند در افراد با هر قومیتی رخ دهد، اما شیوع آن بسته به منطقه جغرافیایی متفاوت است. این بیماری بیشتر در افراد اروپایی تبار تشخیص داده می شود. با این حال، این می تواند به دلیل عوامل ژنتیکی و تشخیصی باشد.
- چاقی دوران کودکی: برخی از مطالعات نشان داده اند که چاقی دوران کودکی ممکن است با افزایش خطر ابتلا به بیماری سلیاک مرتبط باشد. مکانیسم های پشت این ارتباط هنوز در دست بررسی است.
توجه به این نکته مهم است که همه افراد مبتلا به این عوامل خطر به بیماری سلیاک مبتلا نمی شوند و علل دقیق این وضعیت همچنان موضوع تحقیقات در حال انجام است. اگر یک یا چند مورد از این عوامل خطر را دارید یا علائم مرتبط با بیماری سلیاک را تجربه می کنید، توصیه می شود برای آزمایش و تشخیص مناسب با یک ارائه دهنده مراقبت های بهداشتی مشورت کنید. تشخیص و درمان به موقع می تواند به مدیریت این بیماری و جلوگیری از عوارض کمک کند.
بیماری سلیاک چه تفاوتی با حساسیت به گلوتن دارد؟
بیماری سلیاک یک اختلال خود ایمنی با پاسخ های ایمنی خاص است که روده کوچک را در پاسخ به مصرف گلوتن هدف قرار می دهد. حساسیت به گلوتن، همچنین به عنوان حساسیت گلوتن غیر سلیاک شناخته می شود، شامل تجربه علائم گوارشی و سیستمیک در پاسخ به گلوتن است، اما بدون جنبه های خودایمنی و آسیب زا که در بیماری سلیاک دیده می شود.
بیماری سلیاک در چه سن هایی شیوع بیشتری دارد؟
بیماری سلیاک در هر سنی ممکن است ایجاد شود. این بیماری بیشتر در دوران کودکی تشخیص داده می شود، اما می تواند در بزرگسالان نیز ظاهر شود. مشاهده شده است که در مراحل مختلف زندگی، از نوزادی تا اواخر بزرگسالی، رشد می کند.
آیا بیماری سلیاک وابستگی به جنس دارد؟
بیماری سلیاک می تواند افراد با هر جنسیتی را درگیر کند. سوگیری جنسیتی قابل توجهی در بروز آن وجود ندارد. این می تواند بر مردان و زنان تأثیر بگذارد.
شایع ترین علائم بیماری سلیاک چیست؟
بیماری سلیاک سوگیری جنسیتی قابل توجهی نشان نمی دهد، به این معنی که می تواند افراد با هر جنسیتی را تحت تاثیر قرار دهد. هم مردان و هم زنان در معرض ابتلا به بیماری سلیاک هستند. شیوع این عارضه تفاوت معنی داری را بین دو جنس نشان نمی دهد و می تواند در مردان و زنان ظاهر شود.
آزمایش EMA چه تفاوتی با آزمایش آنتی بادی ضد ترانس گلوتامیناز بافتی (tTG) دارد؟
تست آنتی بادی آنتی اندومیزیال (EMA) و تست آنتی بادی ضد ترانس گلوتامیناز (tTG) هر دو تست های سرولوژیکی هستند که در تشخیص بیماری سلیاک استفاده می شوند. در حالی که آنها هدف تشخیصی یکسانی دارند، از چند جهت کلیدی متفاوت هستند:
آنتی ژن هدف:
- تست EMA اندومیزیوم را هدف قرار می دهد که لایه ظریفی از بافت همبند است که فیبرهای عضلانی را احاطه کرده است. وجود آنتی بادی های EMA نشان دهنده پاسخ خود ایمنی به آسیب ناشی از گلوتن به اندومیزیوم است.
- تست آنتی بادی tTG ترانس گلوتامیناز بافتی را هدف قرار می دهد، آنزیمی که در پاسخ خود ایمنی به گلوتن نقش دارد. سطوح بالا از آنتی بادی های tTG وجود بیماری سلیاک را نشان می دهد.
روش انجام تست:
- تست EMA معمولاً با استفاده از ایمونوفلورسانس غیرمستقیم انجام می شود. این شامل استفاده از سرم بیمار بر بخش هایی از مری میمون یا بافت بند ناف انسان است. نتیجه مثبت زمانی تایید می شود که یک الگوی فلورسنت مشخصه (الگوی شبکه ای) در زیر میکروسکوپ مشاهده شود.
- آزمایش آنتی بادی tTG اغلب با استفاده از روش ایمونوسوربنت متصل به آنزیم (ELISA) انجام می شود. سطح آنتی بادی های tTG را در سرم خون بیمار اندازه گیری می کند.
ایزوتیپ ایمونوگلوبولین سرم:
- آنتی بادی های EMA معمولاً از ایزوتیپ IgA هستند، هرچند گاها IgG هم بررسی می شود. IgA EMA شکل اولیه ای است که در افراد با سطح IgA نرمال آزمایش شده است.
- آنتی بادی های tTG می توانند از ایزوتیپ IgA یا IgG باشند. IgA tTG شکل اولیه ای است که در بیمارانی که سطح IgA طبیعی دارند استفاده می شود، در حالی که IgG tTG در افراد مبتلا به کمبود IgA استفاده می شود.
هر دو تست ابزارهای ارزشمندی در تشخیص بیماری سلیاک هستند و انتخاب این که کدام آزمایش استفاده شود ممکن است به شیوه های آزمایشگاهی، شرایط بیمار و ترجیحات منطقه ای بستگی داشته باشد. در عمل، ارائه دهندگان مراقبت های بهداشتی ممکن است از ترکیبی از تست های سرولوژیکی و ارزیابی بالینی برای تایید تشخیص بیماری سلیاک استفاده کنند، که اغلب با بیوپسی روده کوچک برای تایید قطعی دنبال می شود.
چه عواملی می تواند منجر به نتایج مثبت کاذب یا منفی کاذب تست EMA شود؟
نتایج مثبت کاذب EMA نادر است اما ممکن است به دلیل اشتباهات آزمایشگاهی یا شرایط پزشکی خاص رخ دهد. منفی کاذب می تواند ناشی از نمونه های ناکافی بافت، سطوح ناکافی EMA در سرم بیمار یا مشکلات در فرآیند آزمایش باشد.
آیا نتیجه مثبت تست EMA برای تشخیص بیماری سلیاک کافی است یا آزمایشات تکمیلی لازم است؟
در حالی که یک تست EMA مثبت برای بیماری سلیاک بسیار اختصاصی است، تشخیص قطعی معمولاً شامل ترکیبی از ارزیابی بالینی، سایر آزمایشهای سرولوژیکی (مانند tTG-IgA) و اغلب بیوپسی تاییدی روده کوچک است. این آزمایشات اضافی به اطمینان از دقت در تشخیص بیماری کمک می کند.
در سایت South Tees Hospitals NHS Foundation Trust در مورد Anti-Endomysial Antibody (EMA) بیشتر بخوانید:
آنتی بادی EMA-IgA اختصاصی ترین آزمایش برای بیماری سلیاک یا درماتیت هرپتی فرمیس است. آنتی بادی های ضد tTg IgA مانند اکثر آنتی بادی های ضد اندومیزیال IgA هستند. آنها نسبت به آنتی بادی های ضد اندومیزیال حساس تر هستند اما کمی کمتر اختصاصی هستند. از آنجایی که anti-tTg را می توان به راحتی خودکار کرد، این آزمایش به عنوان یک تست غربالگری استفاده می شود. همه سرم های مثبت آنتی بادی های IgA anti-tTg برای آنتی بادی های EMA-IgA مورد سنجش قرار می گیرند.
مطالب مرتبط در متااورگانون:
شاید این مطلب برای شما مفید باشد:
الگوریتم تشخیصی بیماری سلیاک | Diagnostic algorithm of celiac disease
شاید این مطلب برای شما مفید باشد:
آزمایش آنتی بادی های ضد ساکارومایسس سرویزیه (ASCA) | Anti-Saccharomyces cerevisiae Antibodies
شاید این مطلب برای شما مفید باشد:
آزمایش آنتی بادی ماهیچه صاف (SMA) و آنتی بادی F-اکتین (F-Actin) | Anti Smooth Muscle Antibody
منابع مقاله
Dahlbom I, Olsson M, Forooz NK, Sjoholm AG, Truedsson L, Hannson T: Immunoglobulin G (IgG) anti-tissue transglutaminase antibodies used as markers for IgA-deficient celiac disease patients. Clin Diagn Lab Immunol. 2005 Feb;12(2): 254-258. doi: 10.1128/CDLI.12.2.254-258.2005
Korponay-Szabo IR, Dahlbom I, Laurila K, et al: Elevation of IgG antibodies against tissue transglutaminase as a diagnostic tool for coeliac disease in selective IgA deficiency. Gut. 2003 Nov 52(11):1567-1571.doi: 10.1136/gut.52.11.1567
Kumar V, Jarzabek-Chorzelska M, Sulej J, Karnewska K, Farrell T, Jablonska S: Celiac disease and immunoglobulin A deficiency: How effective are the serological methods of diagnosis? Clin Diagn Lab Immunol. 2002 Nov;9(6):1295-1300.doi:10.1128/CDLI.9.6.1295-1300.2002
Elwenspoek MMC, Jackson J, Dawson S, et al: Accuracy of potential diagnostic indicators for coeliac disease: a systematic review protocol. BMJ Open. 2020 Oct 5;10(10):e038994. doi: 10.1136/bmjopen-2020-038994
. Peters MS, McEvoy MT: IgA antiendomysial antibodies in dermatitis herpetiformis. J Am Acad Dermatol. 1989 Dec;21(6):1225-1231
Chorzelski TP, Buetner EH, Sulej J, et al: IgA anti-endomysium antibody. A new immunological marker of dermatitis herpetiformis and coeliac disease. Br J Dermatol. 1984 Oct;111(4):395-402
Kapuscinska A, Zalewski T, Chorzelski TP, et al: Disease specificity and dynamics of changes in IgA class anti-endomysial antibodies in celiac disease. J Pediatr Gastroenterol Nutr. 1987 Jul-Aug;6(4):529-534. doi: 10.1097/00005176-198707000-00006
4. ELWENSPOEK MMC, JACKSON J, DAWSON S, ET AL: ACCURACY OF POTENTIAL DIAGNOSTIC INDICATORS FOR COELIAC DISEASE: A SYSTEMATIC REVIEW PROTOCOL. BMJ OPEN. 2020 OCT 5;10(10):E038994. DOI: 10.1136/BMJOPEN-2020-038994