آزمایش جهش KRAS
- چرا و با چه هدفی آزمایش جهش KRAS درخواست می شود؟
- چه زمانی و در صورت داشتن چه علائمی آزمایش جهش KRAS بایستی انجام شود؟
- نمونه مورد نیاز برای آزمایش جهش KRAS:
- روش های مختلف آزمایشگاهی انجام آزمایش جهش KRAS:
- آمادگی قبل از انجام آزمایش جهش KRAS:
- چه چیزی در آزمایش جهش KRAS این آزمایش مورد بررسی قرار می گیرد؟
- اهمیت بالینی جهش در ژن KRAS:
- سوالات متداول
- آزمایش بیوپسی مایع | DNA تومور در گردش (ctDNA) | Liquid biopsy | سلول های تومور در گردش (CTC) | Circulating Tumor Cell Count
- چگونه از نتایج آزمایش جهش KRAS استفاده می شود؟
- چه زمانی آزمایش جهش KRAS درخواست می شود؟
- نتیجه آزمایش جهش KRAS چه چیزی را نشان می دهد؟
- آیا چیز دیگری هست که باید بدانم؟
- آیا همه افراد مبتلا به سرطان باید آزمایش جهش KRAS را انجام دهند؟
- آیا این آزمایش و درمان دارویی برای انواع دیگر سرطان مفید است؟
- آیا تکرار آزمایش جهش KRAS ضروری است؟
- آیا به جای بافت توموری می توان این آزمایش را روی خون انجام داد؟
- مطالب مرتبط در متااورگانون:
- آزمایش های ژنتیکی برای درمان هدفمند سرطان
- بازآرایی (ژن ALK) | ALK (گیرنده لنفوم آناپلاستیک تیروزین کیناز) | EML4-ALK Fusion Protein
- آزمایش موتاسیون EGFR | گیرنده فاکتور رشد اپیدرمی | HER-1 | erbB-1
- آزمایش بیوپسی مایع | DNA تومور در گردش (ctDNA) | Liquid biopsy | سلول های تومور در گردش (CTC) | Circulating Tumor Cell Count
آزمایش جهش KRAS امکان تشخیص و شناسایی جهش در ژن KRAS را با استفاده از DNA استخراج شده از نمونه بافت توموری، که از طریق بیوپسی به دست می آید را فراهم می کندجهش KRAS یک عامل پیش بینی کننده منفی برای درمان با آنتی بادی گیرنده فاکتور رشد ضد اپیدرمی در سرطان متاستاتیک کولورکتال (CRC) است.
اسامی دیگر:
- K-Ras
چرا و با چه هدفی آزمایش جهش KRAS درخواست می شود؟
آزمایش جهش KRAS معمولاً در انکولوژی، به ویژه در مدیریت سرطان کولورکتال (CRC)، سرطان ریه و سایر بدخیمی ها درخواست می شود. این آزمایش جهش های خاصی را در ژن KRAS شناسایی می کند، که نقش مهمی در مسیرهای سیگنال دهی سلولی دارد که رشد و تکثیر سلولی را تنظیم می کند.
پیش بینی پاسخ به درمان: در سرطان کولورکتال، بیماران با جهش های خاص KRAS کمتر به درمان های هدفمند ضد EGFR (گیرنده فاکتور رشد اپیدرمی) مانند ستوکسیماب و پانیتوموماب پاسخ می دهند. بنابراین، تعیین وضعیت جهش KRAS به تصمیم گیری در مورد درمان کمک می کند. بیماران مبتلا به KRAS نوع وحشی (غیر جهش یافته) به احتمال زیاد از درمان ضد EGFR بهره مند می شوند، در حالی که بیماران دارای جهش KRAS اغلب کاندیدای چنین درمانی نیستند.
شاخص پیش آگهی: وضعیت جهش KRAS همچنین می تواند به عنوان یک شاخص پیش آگهی عمل کند. مطالعات نشان داده اند که بیماران CRC با جهش KRAS ممکن است در مقایسه با بیماران مبتلا به KRAS نوع وحشی، پیش آگهی بدتری داشته باشند.
پزشکی شخصی: آزمایش KRAS با کمک به پزشکان برای ایجاد استراتژی های درمانی بر اساس مشخصات مولکولی تومور به رویکردهای پزشکی شخصی کمک می کند. این می تواند منجر به درمان های مؤثرتر و هدفمندتر شود، به طور بالقوه باعث بهبود نتایج بیمار و به حداقل رساندن سمیت غیر ضروری مربوط به درمان شود.
چه زمانی و در صورت داشتن چه علائمی آزمایش جهش KRAS بایستی انجام شود؟
مهم است که توضیح داده شود که آزمایش جهش KRAS معمولاً تنها بر اساس علائم انجام نمی شود. در عوض، در ابتدا در زمینههای بالینی خاص، به ویژه در بیماران مبتلا به انواع خاصی از سرطان که جهشهای KRAS نقش دارند، مانند سرطان کولورکتال (CRC) و سرطان ریه سلول غیر کوچک (NSCLC) نشان داده میشود.
علائم مرتبط با این سرطان ها ممکن است باعث بررسی آزمایش KRAS شود، اما تصمیم برای انجام آزمایش معمولاً بر اساس عواملی مانند نوع و مرحله سرطان، گزینه های درمانی و پیامدهای بالقوه برای انتخاب درمان است. با این حال، در اینجا علائمی وجود دارد که معمولاً با CRC و NSCLC مرتبط هستند:
علائم سرطان کولورکتال (CRC):
- تغییرات مداوم در عادات روده (اسهال، یبوست، یا باریک شدن مدفوع)
- خونریزی مقعدی یا خون در مدفوع
- ناراحتی، درد یا گرفتگی شکم
- کاهش وزن بدون دلیل
- خستگی یا ضعف
- احساس عدم تخلیه کامل روده پس از اجابت مزاج
- کم خونی ناشی از فقر آهن (تعداد کم گلبول های قرمز خون)
علائم سرطان ریه سلول غیر کوچک (NSCLC):
- سرفه های مداوم
- درد قفسه سینه که با تنفس عمیق یا سرفه بدتر می شود
- تنگی نفس یا خس خس سینه
- سرفه کردن خون یا مخاط خونی
- گرفتگی صدا یا تغییر صدا
- کاهش وزن بدون دلیل
- خستگی یا ضعف
- عفونت های مکرر تنفسی، مانند ذات الریه یا برونشیت
اگر بیمار با این علائم مراجعه کند و به CRC یا NSCLC تشخیص داده شود، ارزیابی بیشتر، از جمله آزمایشهای مولکولی مانند آزمایش جهش KRAS، ممکن است به عنوان بخشی از اقدامات تشخیصی و برنامهریزی درمانی در نظر گرفته شود.
نمونه مورد نیاز برای آزمایش جهش KRAS:
- ظرف/لوله: ظرف حاوی فرمالین / بلوک پارافینه حاوی بافت توموری
- نوع نمونه: نمونهای از بافت تومور که از طریق بیوپسی به دست میآید / بلوک یا اسلایدهای بافتی ثابت با فرمالین، فیکس شده در پارافین (FFPE).
- حجم نمونه: بلوک بافتی تثبیت شده با فرمالین یا چهار لام بدون رنگ و یک لام رنگ آمیزی شده با H&E
- علل رد نمونه :بلوک تومور حاوی بافت تومور نباشد؛ اسلایدهای شکسته یا لکه دار/ نمونههایی که کلسیمزدایی شدهاند نمونههایی که در فرمالین فیکس نشده باشند، پارافین از نمونه جدا شده باشد.
شاید این مطلب برای شما مفید باشد:
روش های مختلف جمع آوری نمونه های آزمایشگاه
شاید این مطلب برای شما مفید باشد:
لوله های آزمایش و ضد انعقادها (Test tubes and Anticoagulants)
شاید این مطلب برای شما مفید باشد:
ذخیره سازی نمونه های آزمایشگاهی
روش های مختلف آزمایشگاهی انجام آزمایش جهش KRAS:
روش واکنش زنجیره ای پلیمراز (PCR):
PCR یک تکنیک زیست شناسی مولکولی پرکاربرد است که بخش های خاصی از DNA را تقویت می کند و امکان تشخیص تغییرات ژنتیکی مانند جهش ها را فراهم می کند. هنگامی که برای آزمایش جهش KRAS اعمال می شود، PCR امکان تکثیر انتخابی ناحیه ژن KRAS حاوی مکان های جهش شناخته شده را فراهم می کند. در اینجا یک مرور کلی از روش PCR برای آزمایش جهش KRAS آورده شده است:
طراحی پرایمر: اولین گام در آزمایش جهش KRAS مبتنی بر PCR شامل طراحی پرایمرهای خاصی است که در کنار ناحیه هدف در ژن KRAS قرار دارند. این پرایمرها معمولاً برای تقویت هر دو آلل نوع وحشی و جهش یافته طراحی شده اند و اطمینان حاصل می کنند که همه انواع احتمالی شناسایی می شوند. علاوه بر این، پرایمرهای اختصاصی آلل ممکن است برای تقویت انتخابی توالی های جهش یافته خاص مورد استفاده قرار گیرند و حساسیت سنجش را افزایش دهند.
استخراج DNA: قبل از تکثیر PCR، DNA باید از نمونه بیمار استخراج شود که می توان آن را از منابع مختلفی مانند بافت تومور، خون یا سایر مایعات بدن به دست آورد. استخراج DNA با کیفیت بالا برای نتایج دقیق PCR بسیار مهم است و تضمین می کند که DNA الگوی کافی برای تکثیر وجود دارد.
تقویت PCR: فرآیند تقویت PCR شامل چرخه های متعدد دناتوراسیون، بازپخت و گسترش است که هر یک توسط آنزیم DNA پلیمراز و شرایط دمایی خاص تسهیل می شود. مخلوط واکنش PCR معمولاً شامل اجزای زیر است:
- DNA الگو: DNA استخراج شده از نمونه بیمار به عنوان الگو برای تقویت عمل می کند.
- پرایمرهای Forward و Reverse: پرایمرهای طراحی شده با توالی های مکمل طرفین ناحیه هدف ژن KRAS هیبرید می شوند.
- DNA Polymerase: یک آنزیم DNA پلیمراز پایدار در برابر حرارت، مانند Taq polymerase، سنتز رشته های DNA جدید را کاتالیز می کند.
- دئوکسی نوکلئوتید تری فسفات ها (dNTPs): بلوک های ساختمانی (A، T، C و G) برای سنتز DNA.
- محلول بافر: شرایط مطلوب pH و نمک را برای تقویت PCR حفظ می کند.
پروتکل چرخه PCR معمولاً شامل مراحل زیر است:
- دناتوراسیون: مخلوط واکنش تا دمای بالا (معمولاً 94 تا 98 درجه سانتیگراد) گرم می شود و باعث می شود که الگوی DNA دو رشته ای به رشته های منفرد جدا شود.
- بازپخت: دما کاهش می یابد تا پرایمرها به توالی های مکمل خود روی DNA الگو بازپخت (پیوند) شوند. دمای بازپخت مخصوص توالی پرایمر است و معمولاً حدود 55 تا 65 درجه سانتیگراد است.
- گسترش: دما افزایش می یابد تا DNA پلیمراز بتواند رشته های DNA جدید را با گسترش از آغازگرها در امتداد DNA الگو سنتز کند. این مرحله معمولاً در دمای حدود 72 درجه سانتیگراد رخ می دهد.
- این چرخه ها چندین بار تکرار می شوند (معمولاً 25-40 چرخه)، که هر چرخه مقدار ناحیه هدف DNA را دو برابر می کند.
تشخیص: پس از تکثیر PCR، محصولات DNA حاصل به طور معمول با استفاده از روش های مختلف برای شناسایی جهش های KRAS تجزیه و تحلیل می شوند. این ممکن است شامل الکتروفورز ژل برای تجسم محصولات PCR، تکنیک های توالی یابی مانند توالی یابی Sanger یا توالی یابی نسل بعدی (NGS) یا سنجش های خاص جهش مانند PCR اختصاصی آلل یا آنالیز ذوب با وضوح بالا (HRM) باشد.
تفسیر: نتایج آزمایش جهش KRAS مبتنی بر PCR بر اساس وجود یا عدم وجود جهش در قطعات DNA تکثیر شده تفسیر می شود. وجود آلل های جهش یافته نشان دهنده وجود جهش های KRAS است، در حالی که عدم وجود یک ژنوتیپ KRAS از نوع وحشی را نشان می دهد.
به طور کلی، آزمایش جهش KRAS مبتنی بر PCR یک روش حساس و پرکاربرد برای تشخیص جهش در ژن KRAS است که اطلاعات ارزشمندی را برای تشخیص سرطان، پیش آگهی و انتخاب درمان ارائه میکند.
شاید این مطلب برای شما مفید باشد:
واکنش زنجیره ای پلیمراز (PCR) | Polymerase Chain Reaction
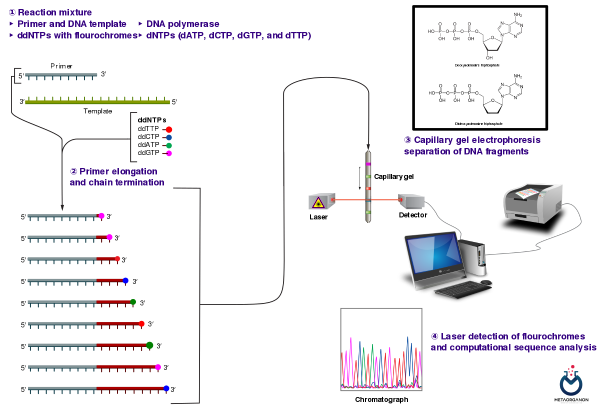
روش توالی یابی سانگر (Sanger Sequencing):
این روش همچنین به عنوان توالی یابی خاتمه زنجیره ای شناخته می شود، یک تکنیک پرکاربرد برای شناسایی جهش در ژن هایی مانند KRAS است. در اینجا شرح مفصلی از فرآیند توالی یابی Sanger برای آزمایش جهش KRAS آمده است:
- جمع آوری نمونه و استخراج DNA: فرآیند با جمع آوری یک نمونه بافت حاوی DNA آغاز می شود. در مورد آزمایش جهش KRAS، این نمونه اغلب از بافت تومور در بیماران سرطانی به دست می آید. سپس DNA با استفاده از روش های استاندارد آزمایشگاهی از بافت استخراج می شود.
- تقویت PCR ناحیه هدف: ناحیه خاصی از ژن KRAS که دارای جهش است، معمولاً اگزون 2 (که شامل کدون های 12 و 13 است) با استفاده از واکنش زنجیره ای پلیمراز (PCR) تقویت می شود. پرایمرهای PCR برای طرفین ناحیه هدف طراحی شده اند و از تقویت انتخابی بخش ژن KRAS مورد نظر اطمینان حاصل می کنند.
- تصفیه PCR: پس از تکثیر، محصول PCR برای حذف پرایمرهای اضافی، نوکلئوتیدها و سایر آلاینده هایی که می توانند در واکنش توالی یابی اختلال ایجاد کنند، خالص می شود.
- واکنش توالی چرخه: محصول PCR خالص شده سپس تحت یک واکنش توالی یابی چرخه ای قرار می گیرد. این واکنش شامل استفاده از DNA پلیمراز، پرایمرهای DNA، دی اکسی نوکلئوتیدهای نشاندار شده با فلورسنت (ddNTPs) و دئوکسی نوکلئوتیدهای معمولی (dNTPs) است. DNA پلیمراز رشته DNA را با ترکیب ddNTP های نشاندار شده با فلورسنت، که فاقد گروه 3′-OH مورد نیاز برای افزایش طول زنجیره DNA هستند، گسترش می دهد. در نتیجه، واکنش توالی یابی مجموعه ای از قطعات DNA با طول های مختلف تولید می کند که هر کدام توسط یک ddNTP متفاوت خاتمه می یابند.
- جداسازی قطعات با الکتروفورز: محصولات واکنش توالی یابی، متشکل از قطعات DNA که با ddNTP های نشاندار خاتمه یافته اند، با الکتروفورز مویرگی یا الکتروفورز ژل جدا می شوند. در الکتروفورز مویرگی، قطعات DNA از طریق یک لوله مویرگی نازک پر از ماتریکس پلیمری تحت تأثیر میدان الکتریکی مهاجرت می کنند. قطعات کوچکتر سریعتر از قطعات بزرگتر حرکت می کنند. با عبور قطعات DNA از پنجره تشخیص، لیزر برچسب های فلورسنت را تحریک می کند و نور ساطع شده توسط آشکارساز تشخیص داده می شود.
- تجزیه و تحلیل داده: سیگنال آشکارساز به داده های الکتروفروگرام تبدیل می شود که نشان دهنده توالی نوکلئوتیدها در ناحیه هدف است. الکتروفروگرام با استفاده از نرم افزار تخصصی برای تعیین توالی بخش ژن KRAS تقویت شده با PCR تجزیه و تحلیل می شود. هر گونه انحراف از توالی مرجع ژن KRAS نوع وحشی به عنوان جهش شناسایی شده و در داده های توالی مشروح می شود.
- شناسایی جهش: جهشهای ژن KRAS، مانند جهشهایی که بر کدونهای 12 و 13 تأثیر میگذارند، با مقایسه توالی بهدستآمده از نمونه با یک توالی مرجع از ژن KRAS نوع وحشی شناسایی میشوند. هر گونه تفاوت یا جهش شناسایی شده در توالی نمونه مشروح و گزارش می شود و اطلاعات ارزشمندی برای تشخیص بالینی و تصمیم گیری درمانی در بیماران سرطانی ارائه می دهد.
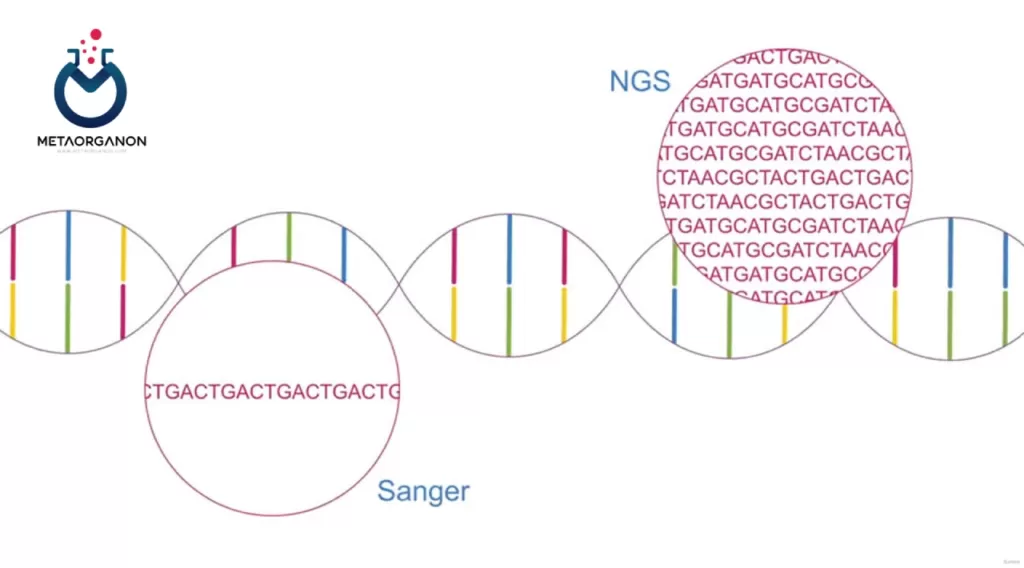
روش توالی یابی Sanger برای آزمایش جهش KRAS دقت و قابلیت اطمینان بالایی را ارائه می دهد و آن را به ابزاری ارزشمند در آزمایشگاه های بالینی برای شناسایی جهش های مرتبط با سرطان های مختلف تبدیل می کند. با این حال، ممکن است در تشخیص جهشهای فرکانس پایین در مقایسه با روشهای حساستر مانند توالییابی نسل بعدی (NGS) محدودیتهایی داشته باشد.
روش توالییابی نسل بعدی (NGS):
NGS که بهعنوان توالییابی با توان بالا نیز شناخته میشود، یک تکنیک قدرتمند است که برای تجزیه و تحلیل جامع توالیهای DNA، از جمله آزمایش جهش KRAS استفاده میشود. در اینجا شرح مفصلی از روش NGS برای آزمایش جهش KRAS آورده شده است:
- جمع آوری نمونه و استخراج DNA: فرآیند با جمع آوری یک نمونه بافت حاوی DNA آغاز می شود. این نمونه به طور معمول از بافت تومور در بیماران سرطانی به دست می آید. سپس DNA با استفاده از روش های استاندارد آزمایشگاهی استخراج می شود.
- آماده سازی کتابخانه: DNA استخراج شده به قطعات کوچکتر، معمولاً از چند صد تا چند هزار جفت باز تقسیم می شود. آداپتورها به مولکول های DNA تکه تکه شده متصل می شوند. این آداپتورها حاوی توالی های لازم برای تقویت و توالی هستند.
- غنی سازی هدف: برای هدف قرار دادن خاص ناحیه ژن KRAS مورد نظر، می توان از روش های مختلفی برای غنی سازی استفاده کرد. این می تواند شامل تقویت PCR نواحی خاص، جذب هیبرید با استفاده از پروب های مخصوص KRAS، یا رویکردهای مبتنی بر آمپلیکون برای هدف قرار دادن ژن KRAS باشد.
- توالی: کتابخانه DNA غنی شده سپس با استفاده از یک پلت فرم NGS مانند Illumina، Ion Torrent یا Pacific Biosciences در معرض توالی یابی قرار می گیرد. در طول توالی یابی، میلیون ها قطعه DNA به طور همزمان در واکنش های موازی توالی یابی می شوند و مقادیر زیادی از داده های توالی را تولید می کنند.
- تحلیل داده: داده های توالی یابی خام تحت تجزیه و تحلیل بیوانفورماتیک قرار می گیرند تا توالی های کوتاه خوانده شده را با ژنوم مرجع تراز کنند و آنها را در توالی های به هم پیوسته طولانی تر (contigs) جمع آوری کنند. سپس توالی های تراز شده با یک توالی مرجع از ژن KRAS مقایسه می شوند تا هر گونه تغییر یا جهش شناسایی شود.
- تشخیص جهش: جهش در ژن KRAS، مانند جایگزینی تک نوکلئوتیدی، درج، حذف، یا تغییرات ساختاری، با مقایسه داده های توالی از نمونه با توالی مرجع شناسایی می شود. ابزارهای بیوانفورماتیک برای حاشیه نویسی و تفسیر جهش های شناسایی شده، ارائه اطلاعات در مورد نوع، مکان و پیامدهای عملکردی بالقوه آنها استفاده می شود.
- تعداد فراخوانی و اعتبارسنجی: جهشهای شناساییشده تحت الگوریتمهای فراخوانی متفاوتی قرار میگیرند تا جهشهای واقعی را از مصنوعات یا خطاهای توالییابی تشخیص دهند. جهش های تایید شده بیشتر مورد تجزیه و تحلیل قرار می گیرند تا اهمیت آنها در زمینه تشخیص، پیش آگهی و درمان سرطان مشخص شود.
- گزارش: نتایج تجزیه و تحلیل جهش KRAS در یک گزارش جامع جمع آوری شده است که شامل جزئیات جهش های شناسایی شده، فراوانی آنها و پیامدهای بالینی مربوطه است. این گزارش توسط پاتولوژیست مولکولی یا انکولوژیست تفسیر می شود و تصمیمات درمانی و استراتژی های مدیریت بیمار را هدایت می کند.
توالی نسل بعدی چندین مزیت را برای آزمایش جهش KRAS ارائه می دهد، از جمله توان عملیاتی بالا، حساسیت، و توانایی تشخیص چندین جهش به طور همزمان. این پروفیل ژنومی جامع بیماران سرطانی را قادر می سازد و رویکردهای درمانی شخصی را بر اساس ویژگی های مولکولی تومورهای آنها تسهیل می کند.
شاید این مطلب برای شما مفید باشد:
NGS | توالی یابی نسل بعدی | Next-generation sequencing | توالی یابی با توان بالا | High-throughput sequencing
آمادگی قبل از انجام آزمایش جهش KRAS:
به آمادگی خاصی نیاز ندارد
چه چیزی در آزمایش جهش KRAS این آزمایش مورد بررسی قرار می گیرد؟
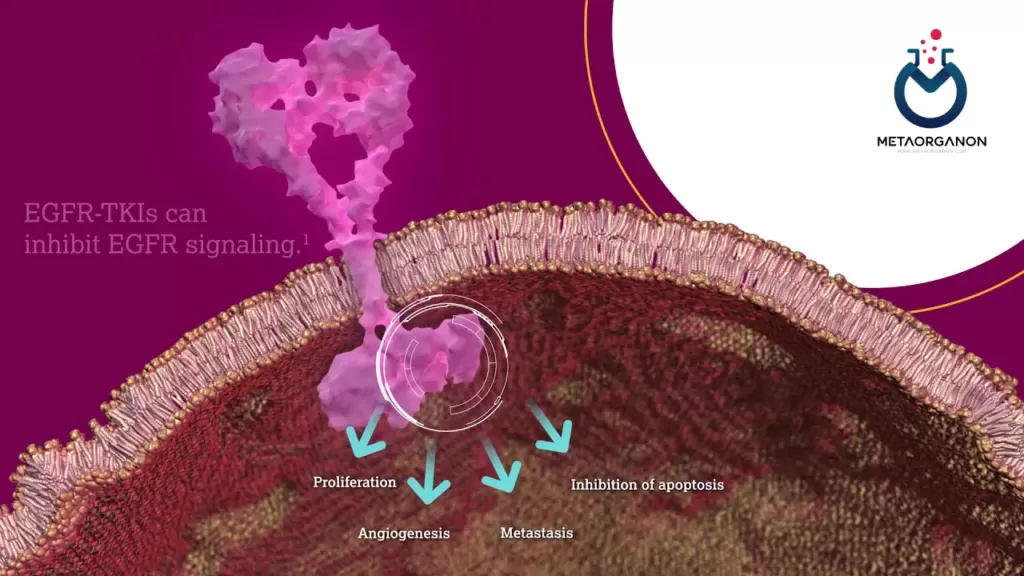
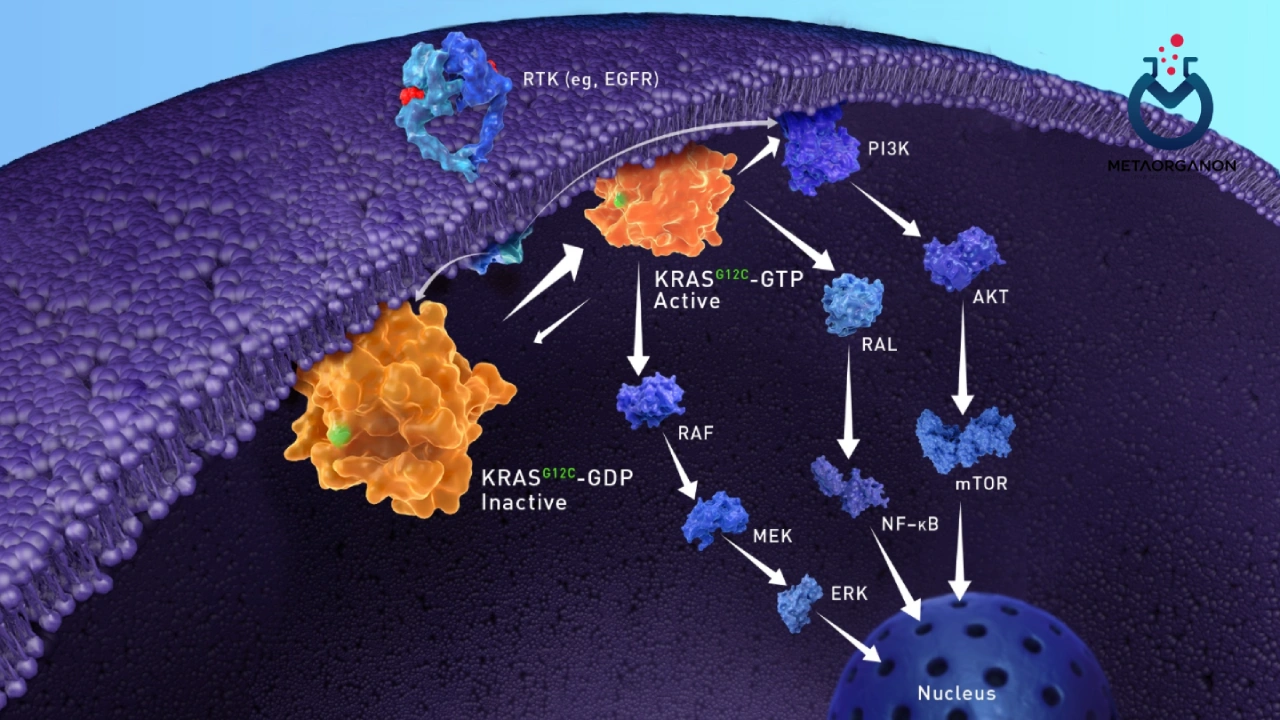
KRAS نام کوتاهی برای ژن همولوگ انکوژن ویروسی سارکوم موش صحرایی Kirsten است. این یکی از گروهی از ژنهای درگیر در مسیری به نام مسیر گیرنده فاکتور رشد اپیدرمی (EGFR) است. این مسیر سیگنالینگ پیچیده شامل اجزای متعددی است که سیگنالها را از بیرون سلول به داخل سلول منتقل میکند تا به تنظیم رشد، تقسیم، بقا و مرگ سلول کمک کند.
EGFR یک گیرنده فاکتور رشد است که با اتصال به لیگاندهای خاص (اپیرگولین و آمفیرگولین) فعال میشود و در نتیجه مسیر RAS/MAPK فعال میشود. فعال شدن این مسیر باعث ایجاد یک آبشار سیگنالینگ می شود که در نهایت تعدادی از فرآیندهای سلولی از جمله تکثیر سلولی را تنظیم می کند. اختلال در مسیر RAS/MAPK یک عامل کلیدی در پیشرفت تومور است.
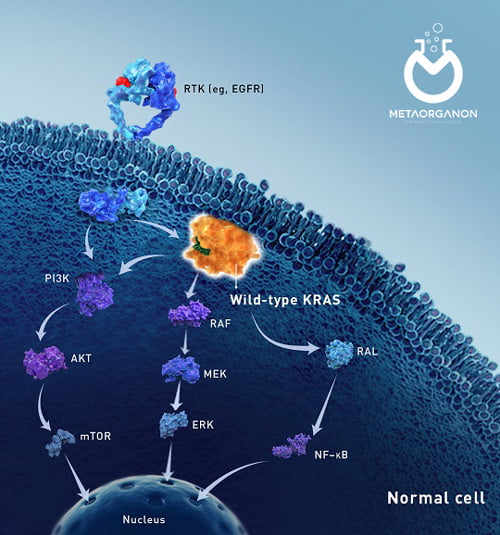
مسیر سیگنالینگ طبیعی EGFR
در بسیاری از سلول های طبیعی، اتصال فاکتور رشد اپیدرمی (EGF) به گیرنده آن (EGFR) در سطح سلول، سیگنال مهمی برای رشد و تقسیم سلولی است. سایر سیگنالهای موجود در مسیر شامل دستهای از پروتئینها به نام آنزیمهای تیروزین کیناز (TK) و پروتئینی است که توسط ژن KRAS تولید میشود. به طور معمول، اجزای مسیر در تنظیم رشد و تقسیم سلولی تعامل دارند و تکثیر سلولی را به صورت جداگانه تحریک نمی کنند.
این آزمایش جهش های خاصی را در ژن KRAS در DNA سلول ها و بافت سرطانی تشخیص می دهد. وجود این جهش ها ممکن است نشان دهنده این باشد که داروهای خاصی در درمان سرطان موثر نیستند.
با این حال، در برخی از سرطان ها، EGFR حتی در غیاب EGF فعال می شود و منجر به رشد و تقسیم سلولی کنترل نشده می شود. داروهایی که آنزیم های EGFR یا تیروزین کیناز را مهار می کنند اغلب برای درمان چنین سرطان هایی مفید هستند. اگرچه برخی از این سرطان ها دارای جهش در ژن KRAS هستند که پروتئین غیرطبیعی K-Ras تولید می کند. پروتئین غیر طبیعی همیشه فعال است و می تواند رشد سلولی را حتی در غیاب سیگنال های EGFR یا سایر پروتئین های تیروزین کینداز تحریک کند.
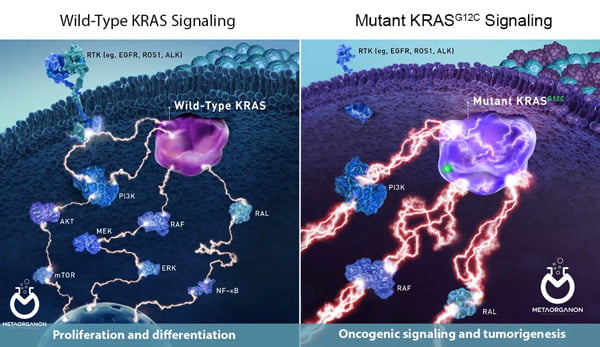
مسیر سیگنالینگ طبیعی و سرطانی EGFR
یکی از شایع ترین تغییرات جسمی در سرطان کولون و NSCLC وجود انواع فعال کننده در پروتونکوژن KRAS است. KRAS توسط EGFR متصل به لیگاند (فعال) برای شروع آبشار سیگنالینگ ناشی از مسیر RAS/MAPK به کار گرفته میشود. از آنجایی که KRAS تغییر یافته اساساً مسیر RAS/MAPK را در پایین دست EGFR فعال میکند، عواملی مانند cetuximab و panitumumab که از اتصال لیگاند به EGFR جلوگیری میکنند، به نظر نمیرسد در حضور KRAS تغییر یافته، فعالیت بازدارنده معنیداری روی تکثیر سلولی داشته باشند.
دادههای کنونی نشان میدهد که اثربخشی درمانهای هدفمند EGFR در سرطان کولون و NSCLC محدود به بیماران مبتلا به تومورهای فاقد جهش KRAS است. یک استثنا، نوع KRAS G12C است که با مهارکنندههای نوع خاص قابل هدف است.
KRAS در 15 تا 20 درصد سرطان های انسان، بیشتر در سرطان پانکراس، سرطان روده بزرگ، سرطان ریه و همچنین سرطان خون جهش یافته است. تقریباً 30 تا 40 درصد سرطان های روده بزرگ و 15 تا 30 درصد سرطان های ریه دارای جهش های KRAS هستند. در حال حاضر، داروهایی که EGFR را هدف قرار می دهند برای درمان سرطان روده بزرگ و سرطان ریه سلول غیر کوچک استفاده می شود. آزمایش جهش KRAS برای تعیین اینکه آیا این داروها در درمان این سرطان ها موثر هستند یا خیر استفاده می شود.
انجمن انکولوژی بالینی آمریکا (ASCO) توصیه کرده است که بیماران مبتلا به سرطان کولون متاستاتیک تشخیص داده شده که کاندیدای درمان ضد EGFR هستند، باید از نظر جهشهای KRAS در یک آزمایشگاه تایید شده اصلاحات آزمایشگاهی بالینی (CLIA) مورد آزمایش قرار گیرند. در صورت منفی بودن جهش های KRAS، این بیماران برای درمان با آنتی بادی ضد EGFR (cetuximab یا panitumumab) مناسب تشخیص داده می شوند.
اهمیت بالینی جهش در ژن KRAS:
جهش در ژن KRAS پیامدهای بالینی قابل توجهی به ویژه در زمینه سرطان شناسی دارد. در اینجا یک مرور کلی از اهمیت بالینی جهش در ژن KRAS آمده است:
سرطان کولورکتال (CRC):
- جهش های KRAS یکی از شایع ترین تغییرات ژنتیکی در CRC است که تقریباً در 30 تا 40 درصد موارد رخ می دهد.
- مطالعات بالینی نشان داده است که بیماران CRC با جهش های KRAS کمتر به درمان های هدفمند ضد EGFR (گیرنده فاکتور رشد اپیدرمی) مانند کتوکسیماب و پانیتوموماب پاسخ می دهند. این داروها مسیر EGFR را مهار می کنند، اما تومورهای جهش یافته KRAS این محاصره را دور می زنند و منجر به مقاومت درمانی می شوند.
- بنابراین، آزمایش جهش KRAS یک عمل استاندارد در بیماران CRC برای هدایت تصمیمات درمانی است. بیماران مبتلا به KRAS نوع وحشی کاندیدای درمان ضد EGFR هستند، در حالی که به بیماران دارای جهش KRAS معمولاً این درمان ها ارائه نمی شود.
سرطان ریه سلول غیر کوچک (NSCLC):
- جهش های KRAS تقریباً در 25 تا 30 درصد موارد NSCLC، به ویژه در بافت شناسی آدنوکارسینوما یافت می شود.
- در حالی که درمانهای هدفمند مانند مهارکنندههای EGFR چشمانداز درمان را برای بیماران NSCLC با جهشهای خاص، مانند جهشهای EGFR و بازآراییهای ALK تغییر دادهاند، گزینههای درمانی برای NSCLC جهشیافته KRAS محدود است.
- جهشهای KRAS با مقاومت در برابر مهارکنندههای EGFR و پیامدهای ضعیفتر در بیماران NSCLC مرتبط است و آنها را به یک نشانگر پیش آگهی مهم تبدیل میکند.
سرطان پانکراس:
- جهش های KRAS تقریباً در همه جا در آدنوکارسینوم مجرای پانکراس (PDAC) وجود دارد و تقریباً 90 درصد تومورها دارای تغییرات KRAS هستند.
- اعتقاد بر این است که این جهش ها رویدادهای اولیه در سرطان زایی پانکراس هستند و نقش مهمی در شروع و پیشرفت تومور دارند.
- در حالی که توسعه درمان های هدفمندی که مستقیماً فعالیت KRAS را مهار می کنند چالش برانگیز بوده است، تحقیقات در حال انجام با هدف شناسایی استراتژی های درمانی جایگزین برای هدف قرار دادن عوامل پایین دست مسیر KRAS در سرطان پانکراس است.
سایر سرطان ها:
- جهش های KRAS در انواع سرطان های دیگر، از جمله سرطان تخمدان، سرطان مثانه، و سرطان سلول سنگفرشی سر و گردن نیز مشاهده می شود، البته در فرکانس های پایین تر.
- در این سرطان ها، جهش های KRAS ممکن است بر رفتار تومور، پیش آگهی و پاسخ به درمان تأثیر بگذارد، اگرچه پیامدهای بالینی ممکن است بسته به نوع تومور و زمینه خاص متفاوت باشد.
به طور کلی، جهش در ژن KRAS پیامدهای بالینی قابل توجهی برای تشخیص سرطان، پیش آگهی و برنامه ریزی درمان دارد. درک مشخصات مولکولی تومورها، از جمله وضعیت جهش KRAS، برای مراقبت شخصی سرطان و هدایت تصمیم گیری درمانی در عمل بالینی ضروری است.
سوالات متداول
انواع مختلف جهش های KRAS شامل په مواردی است؟
جهشه KRAS متنوع هستند و میتوانند در مکانهای مختلف درون ژن رخ دهند که منجر به تغییر در ساختار و عملکرد پروتئین میشود. رایج ترین انواع جهش KRAS عبارتند از:
- جهش نقطه ای (Point Mutations): اینها جایگزین های تک نوکلئوتیدی هستند که منجر به تغییرات اسید آمینه در پروتئین KRAS می شوند. شایع ترین جهش های نقطه ای در KRAS در کدون های 12، 13 و 61 رخ می دهد. این جهش ها منجر به فعال سازی سازنده پروتئین KRAS و اختلال در تنظیم مسیرهای سیگنال دهی پایین دست می شود.
- جهش های Missense: جهش های Missense جهش های نقطه ای هستند که در پروتئین KRAS یک اسید آمینه را جایگزین اسید آمینه دیگری می کنند. آنها می توانند عملکرد پروتئین را با تغییر ساختار یا برهمکنش آن با عوامل پایین دستی تحت تأثیر قرار دهند.
- درج و حذف (Indels): این جهش ها شامل درج یا حذف نوکلئوتیدها در ژن KRAS است که منجر به جهش تغییر چارچوب و تغییر در توالی اسید آمینه پروتئین می شود. ایندل می تواند عملکرد پروتئین را مختل کند و به تومورزایی کمک کند.
- جهش های بی معنی (Nonsense Mutations): جهش های بی معنی کدون های توقف زودرس را در ژن KRAS معرفی می کنند که منجر به پروتئین های کوتاه شده و اغلب غیرعملکردی می شود. این جهشها میتوانند سیگنالدهی طبیعی KRAS را مختل کرده و رشد تومور را افزایش دهند.
- جهش های محل اتصال (Splice Site Mutations): جهش های محل اتصال بر روی پیوند pre-mRNA در طول بیان ژن تأثیر می گذارد و منجر به رونوشت های mRNA نابجا و محصولات پروتئینی بالقوه تغییر یافته می شود. جهش های محل اتصال در KRAS می تواند تنظیم بیان ژن طبیعی را مختل کند و به انکوژن کمک کند.
- تقویت (Amplification): علاوه بر جهش های نقطه ای و ایندل های کوچک، تکثیر ژن KRAS می تواند در سلول های سرطانی نیز رخ دهد. تکثیر ژن منجر به افزایش بیان پروتئین KRAS میشود که منجر به بیش فعال شدن مسیرهای سیگنال دهی پاییندست و رشد و پیشرفت تومور میشود.
آیا جهش KRAS می تواند ارثی باشد؟
به طور کلی، جهش KRAS به معنای کلاسیک ارثی در نظر گرفته نمی شوند. در عوض، آنها معمولاً به صورت جسمی ایجاد میشوند، به این معنی که در DNA سلولهای فردی در طول زندگی فرد رخ میدهند، به جای اینکه از طریق انتقال از والدین به فرزند منتقل شوند.
با این حال، موارد نادری وجود دارد که افراد ممکن است سندرم های ژنتیکی خاصی را به ارث ببرند که آنها را مستعد ابتلا به انواع خاصی از سرطان، از جمله مواردی که دارای جهش KRAS هستند، می کنند. مثلا:
- سندرم نونان (Noonan syndrome): این یک اختلال ژنتیکی است که با ویژگی های متمایز صورت، نقایص قلبی، کوتاهی قد و سایر ناهنجاری های رشدی مشخص می شود. مشخص شده است که برخی از افراد مبتلا به سندرم نونان حامل جهشهای ژرمینال در ژنهای دخیل در مسیر RAS-MAPK از جمله KRAS هستند که ممکن است خطر ابتلا به سرطانهای خاص مانند لوسمی و تومورهای جامد را افزایش دهد.
- سندرم قلبی-صورتی-جلدی (CFC): مشابه سندرم نونان، سندرم CFC در اثر جهش در ژن های مرتبط با مسیر RAS-MAPK از جمله KRAS ایجاد می شود. خطر ابتلا به سرطان در افراد مبتلا به سندرم CFC افزایش یافته است، اگرچه به اندازه سندرم نونان تعریف نشده است.
در حالی که جهشهای مولفه در ژن KRAS نادر است، اما میتواند افراد را مستعد ابتلا به انواع خاصی از سرطان کند. مشاوره و آزمایش ژنتیک ممکن است برای افرادی که سابقه شخصی یا خانوادگی حاکی از سندرم سرطان ارثی مرتبط با جهش های KRAS دارند توصیه شود.
آیا جهش های KRAS در بیوپسی مایع قابل تشخیص است؟
بله، جهشهای KRAS را میتوان در نمونههای بیوپسی مایع، که آزمایشهای غیرتهاجمی هستند که DNA تومور در گردش (ctDNA) یا سایر نشانگرهای زیستی موجود در مایعات بدن مانند خون یا ادرار را تجزیه و تحلیل میکنند، شناسایی کرد. بیوپسی مایع چندین مزیت را نسبت به نمونهبرداریهای بافت سنتی ارائه میکند، از جمله ماهیت کم تهاجمی، توانایی ثبت ناهمگونی تومور، و پتانسیل نظارت طولی بر پاسخ درمانی و پیشرفت بیماری.
تشخیص جهشهای KRAS مبتنی بر بیوپسی مایع معمولاً شامل جداسازی ctDNA از خون یا سایر مایعات بدن و انجام آنالیزهای مولکولی برای شناسایی جهشهای خاص در ژن KRAS است. تکنیک هایی مانند واکنش زنجیره ای پلیمراز (PCR)، توالی یابی نسل بعدی (NGS)، PCR دیجیتال (dPCR) و PCR اختصاصی آلل (AS-PCR) را می توان برای تشخیص و تعیین کمیت جهش های KRAS در نمونه های بیوپسی مایع با حساسیت بالا مورد استفاده قرار داد. و ویژگی
شاید این مطلب برای شما مفید باشد:
آزمایش بیوپسی مایع | DNA تومور در گردش (ctDNA) | Liquid biopsy | سلول های تومور در گردش (CTC) | Circulating Tumor Cell Count
چگونه از نتایج آزمایش جهش KRAS استفاده می شود؟
این آزمایش وجود رایج ترین جهش های ژن KRAS را در DNA سلول های بافت تومور به منظور کمک به درمان سرطان تشخیص می دهد. تجزیه و تحلیل جهش KRAS در درجه اول برای تعیین اینکه آیا سرطان کولون متاستاتیک یا سرطان ریه سلول غیرکوچک شما احتمالاً به درمان استاندارد، یک درمان دارویی ضد EGFR پاسخ می دهد، درخواست می شود. تومورهای دارای جهش KRAS به درمان ضد EGFR پاسخ نمی دهند.
اگر تومور برای شایع ترین جهش KRAS منفی باشد، ممکن است از آزمایش های دیگر جهش های کمتر شایع که با آزمایش فعلی شناسایی نشده اند برای کمک به پیش بینی پاسخ های درمانی استفاده شود.
چه زمانی آزمایش جهش KRAS درخواست می شود؟
آزمایش جهش KRAS معمولاً زمانی درخواست می شود که سرطان متاستاتیک روده بزرگ یا سرطان ریه سلول غیر کوچک تشخیص داده شده باشد. ممکن است در هر زمانی قبل از شروع درمان انجام شود.
نتیجه آزمایش جهش KRAS چه چیزی را نشان می دهد؟
اگر بافت سرطان حاوی جهش KRAS باشد، از درمان های هدفمند EGFR بهره نخواهید برد. وجود یک جهش KRAS همچنین نشاندهنده پیشآگهی ضعیفتر است، اگرچه وجود یک جهش خاص نمیتواند شدت یا تهاجمی بودن سرطان را پیشبینی کند.
نتیجه منفی در تست KRAS نشان میدهد که سرطان ممکن است به درمان ضد EGFR پاسخ دهد، اما فقدان جهش KRAS که توسط آزمایش KRAS تعیین شده است، این امر را تضمین نمیکند. زمانی که نمونه بافت تومور کافی نیست یا زمانی که برخی از سلولهای سرطانی در تومور حاوی جهش هستند و برخی دیگر فاقد جهش هستند، آزمایش منفی کاذب میتواند رخ دهد.
علاوه بر این، ممکن است جهش های KRAS وجود داشته باشد که به دلیل موقعیت خاص آنها در DNA، توسط برخی از آزمایش ها شناسایی نمی شوند. عوامل دیگری نیز ممکن است منجر به سرطان مقاوم به داروهای ضد EGFR شوند.
آیا چیز دیگری هست که باید بدانم؟
دستورالعملهای انجمن انکولوژی بالینی آمریکا و شبکه ملی جامع سرطان، آزمایش جهش KRAS را قبل از درمان ضد EGFR توصیه کردهاند.
درمان های دارویی فعلی ضد EGFR عبارتند از:
- برای سرطان روده بزرگ، آنتی بادی های مونوکلونال ضد EGFR مانند ستوکسیماب (cetuximab) و پانیتوموماب (panitumumab) که اتصال گیرنده ها را مسدود می کنند.
- برای سرطان ریه سلول غیر کوچک، مهارکنندههای تیروزین کیناز ضد EGFR (TKIs) مانند جفیتینیب (gefitinib) و ارلوتینیب (erlotinib) که از فعال شدن مسیرهای سیگنالینگ جلوگیری میکنند.
آیا همه افراد مبتلا به سرطان باید آزمایش جهش KRAS را انجام دهند؟
آزمایش به طور کلی درخواست نمی شود مگر اینکه فرد مبتلا به سرطان روده بزرگ یا سرطان ریه سلول غیر کوچک باشد.
آیا این آزمایش و درمان دارویی برای انواع دیگر سرطان مفید است؟
این امکان وجود دارد، زیرا جهش های KRAS در سایر سرطان ها یافت می شود. این موضوع مورد توجه محققان پزشکی است، اما ممکن است مدتی طول بکشد تا سودمندی آزمایش و درمان در سایر سرطان ها مشخص شود. به عنوان مثال، اینکه آیا جهشهای KRAS با درمان کمتر کارآمد با هدف EGFR در بیماران مبتلا به سرطان پانکراس مرتبط است یا خیر، بحثبرانگیز است و نیاز به بررسی بیشتر دارد.
آیا تکرار آزمایش جهش KRAS ضروری است؟
معمولاً ضروری نیست، اما ممکن است در صورتی رخ دهد که پزشک شما فکر کند که اولین نمونه آزمایش شده ممکن است کافی نبوده باشد. در برخی موارد، یک پزشک ممکن است آزمایش KRAS را برای تشخیص جهش در بخش دیگری از DNA یا جهش نادر KRAS دیگر درخواست کند. گاهی اوقات تومورهای متاستاتیک ممکن است در دسترس نباشند یا بافت محدودی برای آزمایش داشته باشند. در این موارد،از سرطان اولیه شما ممکن است نمونه ای (در صورت وجود) برای آزمایش، به دست آید. اغلب، اگر تومور اولیه دارای جهش KRAS باشد، تومور متاستاتیک نیز چنین خواهد بود.
آیا به جای بافت توموری می توان این آزمایش را روی خون انجام داد؟
برخی از آزمایشگاه های پزشکی می توانند آزمایش جهش KRAS را بر روی بافت تومور و همچنین مغز استخوان و خون انجام دهند. با این حال، پژوهشی که نقش جهش های KRAS را در پاسخ به درمان ارزیابی کرد، تنها بر اساس آزمایش تومور بود. بنابراین، نمونه ارجح برای آزمایش KRAS بافت تومور است.
مطالب مرتبط در متااورگانون:
شاید این مطلب برای شما مفید باشد:
آزمایش های ژنتیکی برای درمان هدفمند سرطان
شاید این مطلب برای شما مفید باشد:
بازآرایی (ژن ALK) | ALK (گیرنده لنفوم آناپلاستیک تیروزین کیناز) | EML4-ALK Fusion Protein
شاید این مطلب برای شما مفید باشد:
آزمایش موتاسیون EGFR | گیرنده فاکتور رشد اپیدرمی | HER-1 | erbB-1
شاید این مطلب برای شما مفید باشد:
آزمایش بیوپسی مایع | DNA تومور در گردش (ctDNA) | Liquid biopsy | سلول های تومور در گردش (CTC) | Circulating Tumor Cell Count
در جای دیگر وب:
- GeneEd: Genetic conditions, Cancer
- American Cancer Society: Lung Cancer (Non-Small Cell)
- American Cancer Society: Colorectal Cancer
- American Cancer Society: Targeted Cancer Therapy
- National Cancer Institute: Targeted Therapy to Treat Cancer
- National Cancer Institute: Targeted Cancer Therapies
- American Society of Clinical Oncology: Understanding Targeted Therapy
منابع مقاله
Current review performed by Hui Li, PhD, DABCC, FACB, FCACB, Clinical Chemist, Dynacare and the Editorial Review Board.
Cicenas J et. al. (2017 April 28). KRAS, TP53, CDKN2A, SMAD4, BRCA1, and BRCA2 Mutations in Pancreatic Cancer. Available online at http://www.mdpi.com/2072-6694/9/5/42. Accessed January 2019.
Chiramel J et. al. (2017 April 26). Targeting the Epidermal Growth Factor Receptor in Addition to Chemotherapy in Patients with Advanced Pancreatic Cancer: A Systematic Review and Meta-Analysis. Available online at http://www.mdpi.com/1422-0067/18/5/909. Accessed January 2019.
Shen et al. (2017 March 07). Diagnostic and prognostic value of blood samples for KRAS mutation identification in lung cancer: a meta-analysis. Available online at http://www.impactjournals.com/oncotarget/index.php?journal=oncotarget&page=article&op=view&path[]=15972&pubmed-linkout=1. Accessed January 2019.
Sobani et. al. (2016 Oct 10). Oncogenic fingerprint of epidermal growth factor receptor pathway and emerging epidermal growth factor receptor blockade resistance in colorectal cancer. Available online at https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5056326/pdf/WJCO-7-340.pdf. Accessed January 2019.
Wang JP et. al. (2015 Jul 20). Erlotinib is effective in pancreatic cancer with epidermal growth factor receptor mutations: a randomized, open-label, prospective trial. Available online at https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4627242/pdf/oncotarget-06-18162.pdf. Accessed January 2019.
Quest Diagnostics [On-line information]. KRAS Mutation Analysis. Available online at https://www.questdiagnostics.com/testcenter/TestDetail.action?ntc=16510. Accessed January 2019.
Lefferts, J. and Tsongalis, G. (2010 March 5). KRAS Mutation Detection: A New Look at an Old Gene. Clinical Chemistry v 56:5, 698–701 [On-line information]. Available online at http://www.clinchem.org/content/56/5/698.full. Accessed May 2012.
Franklin, W. et. al. (2012 January). KRAS Mutation Comparison of Testing Methods and Tissue Sampling Techniques in Colon Cancer. J Mol Diagn. v 12(1): 43–50. [On-line information]. Available online at http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2797717/. Accessed May 2012.
Anderson, S. (2011 August 15). Laboratory Methods for KRAS Mutation Analysis. Medscape Today News from Expert Rev Mol Diagn. v 11(6):635-642 [On-line information]. Available online at http://www.medscape.com/viewarticle/746638. Accessed May 2012.
Markman, M. (Updated 2012 March 28). Colorectal Cancer and KRAS/BRAF. Medscape Reference [On-line information]. Available online at http://emedicine.medscape.com/article/1690010-overview. Accessed May 2012.
Pool, M. (2009 March 2). The Role of KRAS Mutation Testing in the Management of Colorectal Cancer. CAP [On-line information]. Available online at www.cap.org. Accessed May 2012.
(2009 July). KRAS Mutation Testing for Anti-Epidermal Growth Factor Receptor Therapy in Colorectal and Lung Cancer. Mayo Clinic Mayo Medical Laboratories Communique [On-line information]. Available online at http://www.mayomedicallaboratories.com/articles/communique/2009/07.html. Accessed May 2012.
(© 1995-2012). Test ID: KRAS KRAS Gene, 7 Mutation Panel, Tumor. Mayo Clinic Mayo Medical Laboratories [On-line information]. Available online at http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/89378. Accessed May 2012.
Jarboe, E. et. al. (Updated 2011 February). Colorectal Cancer. ARUP Consult [On-line information]. Available online at http://www.arupconsult.com/Topics/ColorectalCancer.html. Accessed May 2012.
(Reviewed 2012 May). KRAS. Genetics Home Reference [On-line information]. Available online at http://ghr.nlm.nih.gov/gene/KRAS. Accessed May 2012.
(Reviewed 2011 December 7). Tumor Markers. National Cancer Institute [On-line information]. Available online at http://www.cancer.gov/cancertopics/factsheet/Detection/tumor-markers. Accessed May 2012.
Liu, X. et. al. (2011 February 13). KRAS Gene Mutation in Colorectal Cancer is Correlated with Increased Proliferation and Spontaneous Apoptosis. Medscape Today News from Am J Clin Pathol. v 135:245-252. [On-line information]. Available online at http://www.medscape.com/viewarticle/736647. Accessed May 2012.
(Revised 2012 February 17). Lung Cancer (Non-Small Cell), How is non-small cell lung cancer diagnosed? American Cancer Society [On-line information]. Available online. Accessed May 2012.
(Revised 2012 January 25). How is colorectal cancer diagnosed? American Cancer Society [On-line information]. Available online. Accessed May 2012.
(Reviewed 2009 November). KRAS Mutation Analysis. Quest Diagnostics [On-line information]. Available online at http://www.questdiagnostics.com/testcenter/testguide.action?fn=Lung/TS_KRAS.htm. Accessed May 2012.
Chowdhuri, S. et. al. (2012 May 8). EGFR and KRAS Mutation Analysis in Cytologic Samples of Lung Adenocarcinoma Enabled by Laser Capture Microdissection. Medscape Today News from Modern Pathology. v 25(4):548-555 [On-line information]. Available online at http://www.medscape.com/viewarticle/763033. Accessed May 2012.
(Reviewed Sept 7 2012) National Cancer Institute. Targeted Cancer Therapies. Available online at http://www.cancer.gov/cancertopics/factsheet/Therapy/targeted. Accessed September 2012.