آزمایش الکترولیت ها و شکاف آنیونی (Anion Gap)
- چرا آزمایش الکترولیت ها درخواست می شود؟
- چه زمانی آزمایش الکترولیت ها بایستی انجام شود؟
- نمونه مورد نیاز برای آزمایش الکترولیت ها:
- نام روش انجام آزمایش الکترولیت ها:
- آمادگی قبل از انجام آزمایش الکترولیت:
- چه چیزی در آزمایش الکترولیت ها مورد بررسی قرار می گیرد؟
- عوامل مداخله گر در آزمایش الکترولیت ها:
- اهمیت بالینی:
- محدوده مرجع:
- سوالات متداول
- چه زمانی آزمایش الکترولیت ها و شکاف آنیونی درخواست می شود؟
- نتیجه آزمایش الکترولیت ها و شکاف آنیونی چه چیزی را نشان می دهد؟
- یکی از نتایج پانل الکترولیت من کمی خارج از محدوده است. این به چه معنا می تواند باشد؟
- درمان عدم تعادل الکترولیت چیست؟
- مطالب مرتبط در متااورگانون:
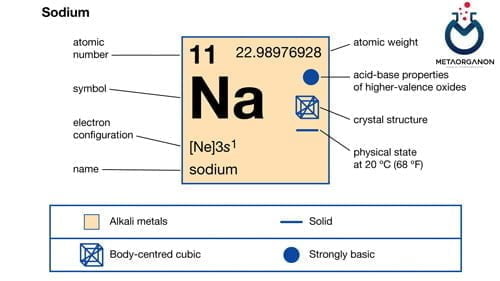
- آزمایش سدیم (Na)
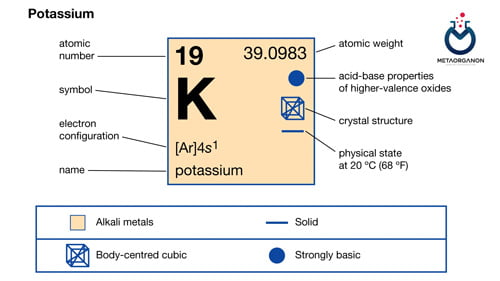
- آزمایش پتاسیم (+K) | Potassium
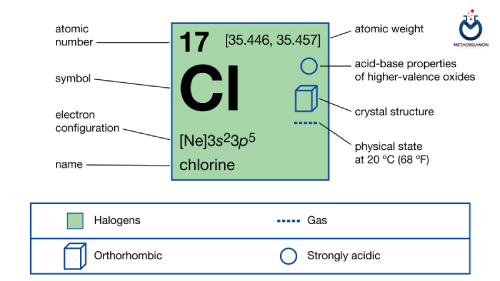
- آزمایش کلرید (Cl) | آزمایش کلر | Chloride | کلراید
- آزمایش بی کربنات (CO2 کل) | -HCO3
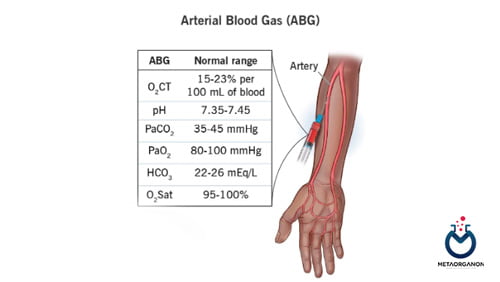
- آزمایش گازهای خون | گاز خون شریانی | گاز خون وریدی
- اسمولالیته (Osmolality) | شکاف اسمولال (Osmolal Gap)
- آزمایش کراتینین (Cr) | Creatinine | کراتینین ادرار
- آزمایش کلسیم (Calcium) | کلسیم کل | کلسیم یونیزه
- آزمایش منیزیم | Magnesium Test | Mg
- آزمایش فسفر | فسفات | فسفات معدنی
- آزمایش ایمونوگلوبولین (Immunoglobulins IgA, IgG, IgM, IgE, IgD)
- در جای دیگر وب:
چرا آزمایش الکترولیت ها درخواست می شود؟
برای شناسایی اختلال در تعادل الکترولیت بدن
چه زمانی آزمایش الکترولیت ها بایستی انجام شود؟
به عنوان بخشی از غربالگری معمول سلامت یا زمانی که پزشک شما مشکوک به عدم تعادل یکی از الکترولیت ها (معمولاً سدیم یا پتاسیم) یا عدم تعادل اسید و باز است.
نمونه مورد نیاز برای آزمایش الکترولیت ها:
- ظرف/لوله: لوله با درب قرمز یا زرد(ترجیحا همراه با ژل جداکننده)
- نوع نمونه: سرم
- حجم نمونه: 0/5 میلی لیتر
شاید این مطلب برای شما مفید باشد:
روش های مختلف جمع آوری نمونه های آزمایشگاه
شاید این مطلب برای شما مفید باشد:
لوله های آزمایش و ضد انعقادها (Test tubes and Anticoagulants)
شاید این مطلب برای شما مفید باشد:
ذخیره سازی نمونه های آزمایشگاهی
نام روش انجام آزمایش الکترولیت ها:
روش الکترود انتخابی یون (ISE):
روش الکترود انتخابی یونی (ISE) یک تکنیک پرکاربرد برای آزمایش الکترولیتهایی مانند سدیم، پتاسیم، کلرید و بی کربنات در علوم آزمایشگاهی پزشکی است. این روش بر الکترودهای انتخابی یونی تکیه دارد که می توانند به طور انتخابی فعالیت یون های خاص را در یک نمونه اندازه گیری کنند. در اینجا توضیح مفصلی از نحوه عملکرد روش ISE آورده شده است:
- اجزای الکترود: تنظیم ISE معمولاً از سه الکترود تشکیل شده است: یک الکترود مرجع، یک الکترود اندازه گیری (الکترود انتخابی یون)، و یک محلول مرجع. هر الکترود نقش مهمی در فرآیند اندازه گیری ایفا می کند.
- الکترود مرجع: الکترود مرجع به طور معمول یک الکترود پایدار با پتانسیل ثابت است. به عنوان یک نقطه مرجع برای الکترود اندازه گیری عمل می کند. الکترود مرجع رایج، الکترود Ag/AgCl است که دارای پتانسیل ثابت و شناخته شده ای است.
- الکترود اندازه گیری (الکترود یونی انتخابی): الکترود اندازه گیری که به عنوان الکترود انتخابی یون نیز شناخته می شود، جزء کلیدی برای اندازه گیری یون خاص مورد نظر (به عنوان مثال، سدیم یا پتاسیم) است. الکترود انتخاب کننده یون به یونی که برای اندازه گیری طراحی شده است حساس است. به عنوان مثال، یک الکترود برای اندازه گیری سدیم به تغییرات غلظت یون سدیم حساس خواهد بود. دارای غشای انتخابی است که فقط به یون هدف اجازه عبور می دهد و اختلاف پتانسیل ایجاد می کند.
- نمونه: محلول نمونه حاوی الکترولیت مورد نظر در تماس با الکترود انتخاب کننده یون قرار می گیرد.
- تبادل یون در غشاء: هنگامی که محلول نمونه با غشای انتخابی الکترود انتخاب کننده یون تماس پیدا می کند، فرآیند تبادل یونی رخ می دهد. غشای انتخابی تنها به یون خاص اجازه عبور می دهد در حالی که یون های دیگر را مسدود می کند. به عنوان مثال، در مورد الکترود انتخابی سدیم، تنها به یون های سدیم اجازه عبور می دهد.
- اندازه گیری اختلاف پتانسیل: با عبور یون های هدف از غشای انتخابی، به دلیل تبادل یونی، اختلاف پتانسیل در سراسر غشا ایجاد می شود. این اختلاف پتانسیل متناسب با غلظت یون خاص در نمونه است.
- اندازه گیری پتانسیل: اختلاف پتانسیل تولید شده در الکترود انتخابی یون نسبت به پتانسیل پایدار الکترود مرجع اندازه گیری می شود. این اختلاف پتانسیل به یک سیگنال الکتریکی قابل اندازه گیری، معمولاً بر حسب میلی ولت (mV) تبدیل می شود.
- کالیبراسیون و تفسیر: برای به دست آوردن نتایج دقیق، سیستم ISE باید با استفاده از محلول های استاندارد با غلظت یون شناخته شده کالیبره شود. منحنی کالیبراسیون برای ارتباط اختلاف پتانسیل با غلظت یون در نمونه استفاده می شود. پتانسیل اندازه گیری شده با منحنی کالیبراسیون برای تعیین غلظت یون در نمونه مقایسه می شود.
- گزارش نتایج: نتیجه نهایی بر حسب واحد غلظت یون (مثلاً mmol/L یا mEq/L) برای الکترولیت خاصی که اندازه گیری می شود گزارش می شود.
روش الکترود انتخابی یون به دلیل دقت و سرعت در اندازه گیری غلظت یون در طیف گسترده ای از کاربردها، به ویژه در آزمایشگاه های بالینی که تجزیه و تحلیل الکترولیت برای تشخیص و درمان بیمار ضروری است، شناخته شده است. کالیبراسیون مناسب، نگهداری الکترودها و روش های کنترل کیفیت برای اطمینان از نتایج دقیق و قابل اعتماد بسیار مهم هستند.
روش نورسنجی شعله یا فلیم فتومتری (Flame Photometry):
روش Flame Photometry، همچنین به عنوان طیفسنجی انتشار شعله شناخته میشود، روشی است که برای آزمایش غلظت برخی الکترولیتها، عمدتاً سدیم و پتاسیم استفاده میشود. این تکنیک تحلیلی بر گسیل مشخصه نور توسط اتم ها زمانی که در شعله ای با دمای بالا برانگیخته می شوند، متکی است. در اینجا شرح مفصلی از روش فتومتری شعله برای آزمایش الکترولیت ها آورده شده است:
- آماده سازی نمونه: محلول نمونه حاوی الکترولیت مورد نظر مانند سدیم یا پتاسیم تهیه می شود. این محلول معمولاً به شکل نمک و اغلب به صورت کلرید یا سولفات است.
- نبولیزاسیون: محلول نمونه آماده شده وارد یک نبولایزر می شود که آن را به یک غبار ریز یا آئروسل تبدیل می کند. این غبار جریان یکنواخت و ثابت نمونه را در شعله تضمین می کند.
- منبع شعله: نورسنجی شعله به منبع شعله با دمای بالا نیاز دارد. پرکاربردترین شعله شعله هوا-استیلن یا شعله هوا-پروپان است. انتخاب شعله به عنصر خاص مورد تجزیه و تحلیل و ابزار مورد استفاده بستگی دارد.
- اتمی شدن و برانگیختگی: نمونه آئروسل شده به شعله وارد می شود، جایی که تحت چندین فرآیند قرار می گیرد:
– اتمی شدن: دمای بالای شعله، نمونه را تبخیر کرده و آن را به اتم های منفرد تبدیل می کند.
– تحریک: با تبخیر شدن اتم ها، انرژی شعله را جذب کرده و برانگیخته می شوند. - انتشار نور: اتم های برانگیخته ناپایدار هستند و با تابش نور در ناحیه مرئی طیف الکترومغناطیسی به حالت اولیه خود باز می گردند. طول موج این نور ساطع شده مختص عنصر مورد تجزیه و تحلیل است. برای سدیم، طول موج مشخصه حدود 589 نانومتر است، در حالی که برای پتاسیم، حدود 766 نانومتر است.
- تک رنگ و آشکارساز: یک تک رنگ برای جداسازی طول موج خاص نور ساطع شده توسط اتم های برانگیخته استفاده می شود. این تضمین می کند که تنها طول موج مورد نظر اندازه گیری می شود. یک آشکارساز، اغلب یک لوله فتو ضربی یا یک فوتودیود، سپس شدت نور ساطع شده را تعیین می کند.
- تنظیم: برای تعیین غلظت الکترولیت در نمونه، منحنی کالیبراسیون ساخته می شود. این کار با تجزیه و تحلیل محلول های استاندارد با غلظت های شناخته شده الکترولیت انجام می شود. رابطه بین غلظت و شدت نور ساطع شده برای ایجاد منحنی کالیبراسیون استفاده می شود.
- اندازه گیری: محلول نمونه به شعله وارد می شود و شدت نور ساطع شده در طول موج مشخصه اندازه گیری می شود.
- تحلیل داده ها: دستگاه شدت نور ساطع شده را ثبت می کند و این مقدار برای تعیین غلظت الکترولیت در نمونه با منحنی کالیبراسیون مقایسه می شود.
- گزارش نتایج: نتیجه نهایی بر حسب واحد غلظت یون (مثلاً mmol/L یا mEq/L) برای الکترولیت خاصی که اندازه گیری می شود گزارش می شود.
فتومتری شعله روشی مطمئن و نسبتا ساده برای اندازه گیری سطوح سدیم و پتاسیم در آزمایشگاه های بالینی و تحقیقاتی است. با این حال، حفظ شرایط شعله دقیق و انجام کالیبراسیون مناسب برای اطمینان از نتایج دقیق و ثابت ضروری است.
روش رنگ سنجی (Colorimetric Method):
روش رنگ سنجی برای انجام آزمایش های الکترولیت، یک تکنیک تحلیلی پرکاربرد است که بر تغییر رنگ محلول برای تعیین غلظت الکترولیت های خاص مانند کلرید و بی کربنات متکی است. این روش بر اساس واکنش بین الکترولیت مورد نظر و یک معرف است که منجر به تغییر رنگ می شود. در اینجا شرح مفصلی از روش رنگ سنجی برای آزمایش الکترولیت ها آورده شده است:
- آماده سازی نمونه: محلول نمونه حاوی الکترولیت مورد آزمایش تهیه می شود. بسته به آزمایش خاص، نمونه ممکن است حاوی یون های کلرید یا بی کربنات باشد.
- انتخاب معرف ها: روش رنگ سنجی به معرف های خاصی نیاز دارد که بتواند با الکترولیت مورد نظر واکنش داده و ترکیب رنگی تولید کند. مثلا:
– برای آزمایش کلرید، معرف معمولی نیترات نقره (AgNO3) است که یک رسوب سفید و نامحلول کلرید نقره (AgCl) را تشکیل می دهد.
– برای آزمایش بی کربنات از معرف مانند برموتیمول آبی یا فنل قرمز استفاده می شود که در پاسخ به تغییرات pH ناشی از وجود یون های بی کربنات تغییر رنگ می دهد. - واکنش و توسعه رنگ: محلول نمونه با معرف مناسب مخلوط شده و واکنش شیمیایی صورت می گیرد. مثلا:
– در مورد آزمایش کلرید، افزودن نیترات نقره منجر به تشکیل یک رسوب سفید رنگ (AgCl) می شود.
– برای آزمایش بی کربنات، معرف در پاسخ به تغییر pH ناشی از حضور یون های بی کربنات، تغییر رنگ می دهد. - اندازه گیری رنگ: تغییر رنگ در محصول واکنش به صورت بصری یا معمولاً با استفاده از رنگ سنج یا اسپکتروفتومتر ارزیابی می شود. این ابزارها می توانند میزان جذب یا عبور نور را در طول موج های خاص اندازه گیری کنند.
- تنظیم: برای تعیین غلظت الکترولیت در نمونه، منحنی کالیبراسیون ساخته می شود. این کار با تجزیه و تحلیل محلول های استاندارد با غلظت های شناخته شده الکترولیت انجام می شود. رابطه بین غلظت و شدت رنگ (جذب یا عبور) برای ایجاد منحنی کالیبراسیون استفاده می شود.
- اندازه گیری: محلول نمونه تحت واکنش رنگ سنجی قرار می گیرد و تغییر رنگ با اندازه گیری میزان جذب یا عبور در طول موج خاص مرتبط با تغییر رنگ، کمی سازی می شود.
- تحلیل داده ها: دستگاه شدت رنگ را ثبت می کند و این مقدار برای تعیین غلظت الکترولیت در نمونه با منحنی کالیبراسیون مقایسه می شود.
- گزارش نتایج: نتیجه نهایی بر حسب واحد غلظت یون (مثلاً mmol/L یا mEq/L) برای الکترولیت خاصی که اندازه گیری می شود گزارش می شود.
روش رنگ سنجی یک تکنیک ارزشمند و پرکاربرد برای اندازه گیری غلظت الکترولیت ها است. این یک راه ساده و مقرون به صرفه برای تجزیه و تحلیل سطوح کلرید و بی کربنات در آزمایشگاه های بالینی و تحقیقاتی ارائه می دهد. جابجایی مناسب نمونه، آماده سازی دقیق معرف و رعایت روش های کالیبراسیون برای به دست آوردن نتایج دقیق و قابل اعتماد ضروری است.
آمادگی قبل از انجام آزمایش الکترولیت:
به آمادگی خاصی نیاز ندارد
چه چیزی در آزمایش الکترولیت ها مورد بررسی قرار می گیرد؟
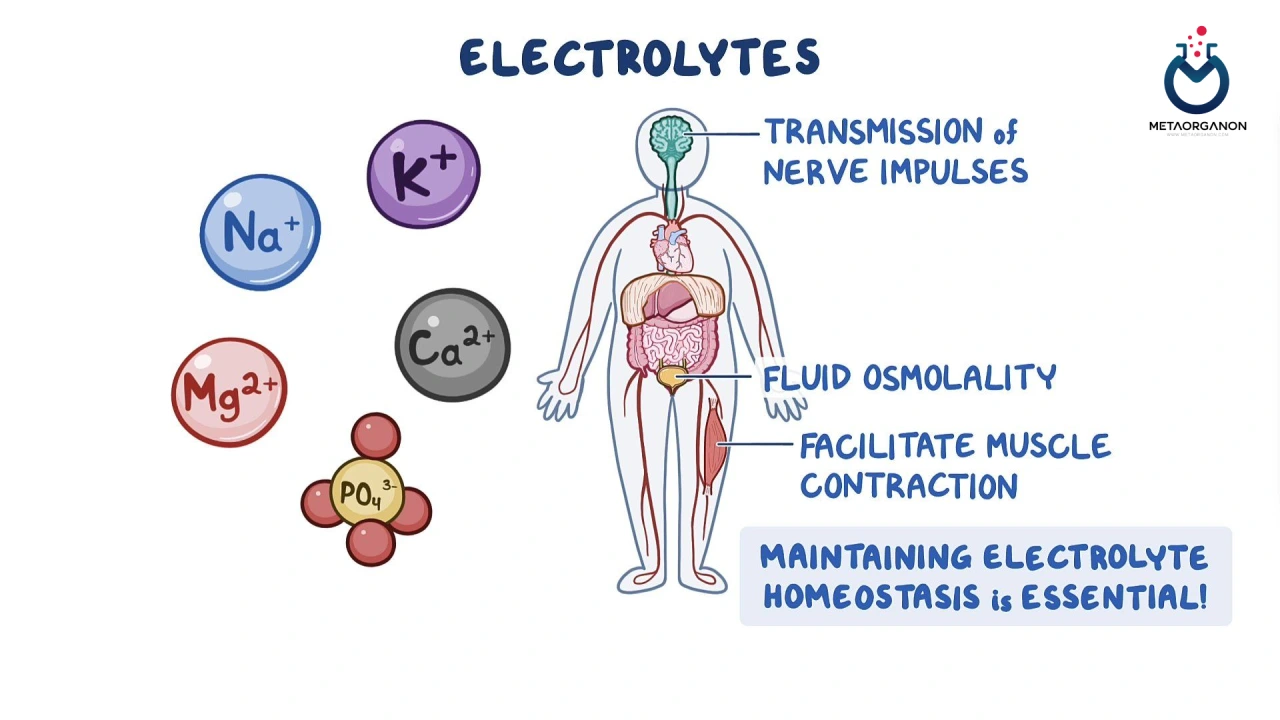
الکترولیت ها مواد معدنی هستند که در بافت های بدن و خون به شکل نمک های محلول یافت می شوند. الکترولیت ها به عنوان ذرات باردار الکتریکی، به انتقال مواد مغذی به داخل و خارج از سلول های بدن، حفظ تعادل آب سالم و تثبیت سطح اسید/باز (pH) بدن کمک می کنند.
پانل الکترولیت سطوح خونی الکترولیت های اصلی بدن را اندازه گیری می کند:
سدیم – بیشترین مقدار سدیم بدن در مایع خارج از سلولهای بدن یافت میشود، جایی که به تنظیم مقدار آب در بدن کمک میکند.
پتاسیم – این الکترولیت عمدتاً در داخل سلول های بدن یافت می شود. مقدار کمی پتاسیم اما حیاتی در پلاسما، یافت می شود. پتاسیم نقش مهمی در تنظیم انقباض عضلات دارد. پایش مداوم پتاسیم مهم است زیرا تغییرات کوچک در سطح پتاسیم می تواند بر ریتم قلب و توانایی انقباض تأثیر بگذارد.
کلرید – این الکترولیت برای کمک به حفظ حالت خنثی الکتریکی محیط بدن (غلظت کاتیونهای با بار مثبت و آنیونهای با بار منفی باید برابر باشد) به داخل و خارج سلولها حرکت میکند و سطح آن معمولاً منعکس کننده سطح سدیم است. به دلیل ارتباط نزدیک آن با سدیم، کلرید به تنظیم توزیع آب در بدن نیز کمک می کند.
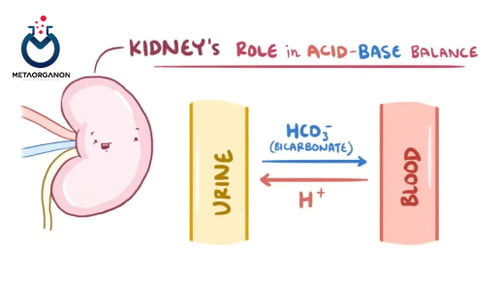
بی کربنات – وظیفه اصلی بی کربنات که توسط کلیه ها دفع و بازجذب می شود، کمک به حفظ سطح pH پایدار (تعادل اسید و باز) و در مرحله دوم، کمک به حفظ حالت خنثی الکتریکی بدن است. بی کربنات همچنین نقش مهمی در انتقال CO2 ایفا می کند. بیشتر CO2 تولید شده توسط بافت های بدن در خون به عنوان بی کربنات به ریه ها منتقل می شود و در آنجا دوباره با تبدیل شدن به CO2 بازدم می شود.

هر بیماری یا شرایطی که بر میزان مایعات در بدن تأثیر بگذارد، مانند کم آبی می تواند بر ریه ها، کلیه ها، متابولیسم بدن و تنفس تأثیر بگذارد و پتانسیل ایجاد عدم تعادل مایعات، الکترولیت ها یا pH (اسیدوز یا آلکالوز) را در بدن دارد. PH نرمال باید در محدوده باریک 7/35 تا 7/45 حفظ شود و الکترولیت ها باید در تعادل باشند تا از عملکرد مناسب فرآیندهای متابولیک و رساندن مقدار مناسب اکسیژن به بافت ها اطمینان حاصل شود.
در حالی که معمولاً سدیم، پتاسیم، کلرید و بی کربنات با هم به عنوان پانل الکترولیت اندازه گیری می شوند، می توان آنها را نیز به صورت جداگانه برای تشخیص/پایش شرایطی که بر الکترولیت های خاص تأثیر می گذارد درخواست داد. بدن همچنین حاوی الکترولیت های دیگری است که بخشی از “پانل الکترولیت” نیستند، اما ممکن است توسط پزشک شما درخواست شوند. اینها عبارتند از: کلسیم (+Ca2)، منیزیم (+Mg2) و فسفات (-PO3).
 شکاف آنیونی چیست؟
شکاف آنیونی چیست؟
شکاف آنیونی (AG یا AGAP) عددی است که با استفاده از نتایج یک پانل الکترولیت محاسبه می شود. تفاوت بین یون های دارای بار مثبت (که کاتیون نامیده می شود) و یون های دارای بار منفی (آنیون ها) را منعکس می کند. شکاف غیر طبیعی آنیون اختصاصیت ندارد – بیماری یا بیماری خاصی را تشخیص نمی دهد – اما می تواند نشان دهنده انواع خاصی از اختلالات متابولیک یا تنفسی یا وجود مواد سمی باشد.
شکاف آنیونی برای کمک به تمایز بین اسیدوز متابولیک شکاف آنیونی و شکاف غیر آنیونی استفاده می شود. اسیدوز به اسیدی شدن بیش از حد بدن اشاره دارد. که می تواند بسیاری از عملکردهای سلولی را مختل کند و در صورت وجود باید در اسرع وقت شناسایی شود. شکاف آنیونی اغلب در بیمارستان و/یا محیط اورژانس برای کمک به تشخیص و مانیتور بیماران حاد استفاده می شود.
به طور خاص، شکاف آنیونی تفاوت بین ذرات الکتریکی اندازه گیری شده و اندازه گیری نشده (یون ها یا الکترولیت ها) را در قسمت مایع خون ارزیابی می کند. بر اساس اصل خنثی بودن الکتریکی بدن، تعداد یون های مثبت (کاتیون ها) و یون های منفی (آنیون ها) باید برابر باشد. با این حال، همه یون ها به طور معمول اندازه گیری نمی شوند. نتیجه محاسبهشده AG نشاندهنده یونهای اندازهگیری نشده است و عمدتاً از آنیونها تشکیل میشود، از این رو «شکاف آنیون» نامیده میشود. رایج ترین فرمول مورد استفاده این است:
شکاف آنیونی (AG) = سدیم – (کلرید + بی کربنات [CO2 کل])
با این حال، فرمول های AG دیگری نیز وجود دارد، بنابراین محدوده های مرجع قابل تعویض نیستند. هر فرمول آزمایشگاهی دارای یک محدوده نرمال ثابت است.
شکاف آنیونی غیر اختصاصی است. زمانی که تعداد آنیونهای اندازهگیرینشده افزایش مییابد، نشاندهنده وضعیت اسیدوز متابولیک شکاف آنیونی است، اما به پزشک نمیگوید که چه چیزی باعث عدم تعادل میشود. اسیدوز متابولیک باید برای بازگرداندن تعادل اسید/باز درمان شود، اما بیماری زمینهای نیز باید شناسایی و درمان شود.
علت می تواند شامل دیابت کنترل نشده، گرسنگی، آسیب کلیه، و مصرف مواد توکسیک بالقوه مانند ضد یخ، مقادیر بیش از حد آسپرین (سالیسیلات ها) یا متانول باشد. شکاف آنیون خفیف زمانی دیده می شود که آلبومین (یک آنیون و همچنین یک پروتئین) کم است، در حالی که ایمونوگلوبولین ها (کاتیون ها و همچنین پروتئین ها) افزایش می یابند.
عوامل مداخله گر در آزمایش الکترولیت ها:
هیپرلیپیدمی ممکن است باعث کاهش سدیم و کاهش کاذب AG شود.
مقادیر نرمال شکاف آنیونی با توجه به مقادیر نرمال مختلف الکترولیت ها(بسته به روش های آزمایشگاهی اندازه گیری) متفاوت است.
از داروهایی که شکاف آنیونی را افزایش می دهند می توان به کاربنی سیلین، مهارکننده های کربنیک انیدراز (به عنوان مثال، استازولامید)، دیورتیک ها، اتانول، متانول، پنی سیلین و سالیسیلات اشاره کرد.
از داروهایی که شکاف آنیونی را کاهش می دهند می توان به استازولامید، لیتیوم، پلی میکسین B، اسپیرونولاکتون و سولینداک اشاره کرد.
برخی از داروها مانند استروئیدهای آنابولیک، کورتیکواستروئیدها، ملین ها، داروهای سرفه و داروهای ضد بارداری خوراکی ممکن است باعث افزایش سطح سدیم شوند. سایر داروها مانند دیورتیک ها، کاربامازپین و داروهای ضد افسردگی سه حلقه ای ممکن است باعث کاهش سطح سدیم شوند.
داروهایی که بر سطح سدیم خون تأثیر می گذارند نیز باعث تغییر در کلرید می شوند. مصرف بیشتر از دوز توصیه شده آنتی اسیدها نیز می تواند باعث کاهش سطح کلرید شود.
برخی داروها ممکن است سطح بی کربنات (CO2 کل) را افزایش دهند. که شامل فلودروکورتیزون، باربیتورات ها، هیدروکورتیزون، دیورتیک های حلقه و استروئیدها می شوند. داروهایی که ممکن است سطح بی کربنات (CO2 کل) را کاهش دهند عبارتند از متی سیلین، نیتروفورانتوئین، تتراسایکلین، دیورتیک های تیازیدی و تریامترن.
برخی از دیورتیک ها، که ممکن است برای افراد مبتلا به اختلالاتی مانند فشار خون بالا یا بیماری کلیوی استفاده شوند، تمایل دارند سطح پتاسیم را به سطوح پایین خطرناکی کاهش دهند. برای جلوگیری از این مشکل، یک پزشک ممکن است یک دیورتیک نگهدارنده پتاسیم تجویز کند.
یک علت غیر فیزیولوژیکی سطح بالای پتاسیم در نمونه بیمار، نشت از سلول های خونی است، اگر نمونه با دقت مورد استفاده قرار نگیرد یا حمل و نقل آن به آزمایشگاه با تاخیر همراه باشد این اتفاق رخ می دهد.که میتواند منجر به افزایش کاذب نتیجه آزمایش شود. هنگامی که یک پزشک مشکوک است که نتیجه پتاسیم با وضعیت بیمار سازگار نیست، آزمایش پتاسیم ممکن است تکرار شود.
شاید این مطلب برای شما مفید باشد:
تداخلات دارویی در آزمایش ها | Interference of medicines in laboratory tests
اهمیت بالینی:
افزایش شکاف آنیونی:
- اسیدوز لاکتیک
- کتواسیدوز دیابتی
- کتواسیدوز الکلی
- مسمومیت با الکل
- گرسنگی: این بیماری با افزایش یون های اسیدی مانند لاکتات، هیدروکسی بوتیرات یا استواستات همراه است. -HCO3 این اسیدها را خنثی می کند، سطح -HCO3 کاهش می یابد و AG از نظر ریاضی افزایش می یابد.
- نارسایی کلیوی: آنیون های اسید آلی اورمیک (فسفات، سولفات ها و غیره) در نتیجه در خون تجمع می کنند.در دفع ضعیف این اسیدها هیدروژن با بی کربنات ترکیب می شود تا pH هموستاتیک را حفظ کند. سطح بی کربنات کاهش می یابد و AG از نظر ریاضی افزایش می یابد.
- افزایش دفع بی کربنات از طریق دستگاه گوارش (اسهال): افزایش دفع بی کربنات ممکن است رخ دهد، در نتیجه AG به طور ریاضی افزایش می یابد.
- هیپوآلدوسترونیسم: آلدوسترون ترشح اسید را در لوله های انتهایی کلیه در ازای سدیم تحریک می کند. با مقادیر ناکافی آلدوسترون، اسید ساخته شده و با بی کربنات ترکیب می شود. سطوح بی کربنات کاهش می یابد و AG افزایش می یابد.
کاهش شکاف آنیونی:
- مصرف بیش از حد مواد قلیایی: افزایش محصولات قلیایی به ویژه در کودکان، باعث افزایش محصولات -HCO3و کاهش ریاضی AG می شود.
- مولتیپل میلوما: زنجیره M پروتئین های تولید شده توسط سلول های پلاسما نئوپلاستیک کاتیونی هستند که باعث کاهش جبرانی کاتیون های اندازه گیری شده و افزایش آنیون های اندازه گیری شده برای حفظ خنثی الکتریکی می شود.
- استفراغ مزمن یا لاواژ معده: از دست دادن HCl باعث کاهش کلرید و افزایش -HCO3 می شود.که از نظر ریاضی AG را کاهش می دهد.
- هیپرآلدوسترونیسم: این بیماران مقادیر زیادی از یون های پتاسیم و هیدروژن را از دست می دهند که باعث آلکالوز متابولیک همراه با کاهش AG می شود.
- هیپوپروتئینمی: از دست دادن پروتئین های آنیونی به طور مستقیم باعث کاهش AG می شود.
- سمیت لیتیوم: افزایش کاتیون های معدنی باعث کاهش کاتیون های اندازه گیری شده و در نتیجه کاهش AG می شود.
محدوده مرجع:
SODIUM
- <1 year: not established
- > or =1 year: 135-145 mmol/L
POTASSIUM
- <1 year: not established
- > or =1 year: 3.6-5.2 mmol/L
CHLORIDE
- <1 year: not established
- 1-17 years: 102-112 mmol/L
- > or =18 years: 98-107 mmol/L
BICARBONATE
:Males
- <1 year: not established
- 1-2 years: 17-25 mmol/L
- 3 years: 18-26 mmol/L
- 4-5 years: 19-27 mmol/L
- 6-7 years: 20-28 mmol/L
- 8-17 years: 21-29 mmol/L
- > or =18 years: 22-29 mmol/L
:Females
- <1 year: not established
- 1-3 years: 18-25 mmol/L
- 4-5 years: 19-26 mmol/L
- 6-7 years: 20-27 mmol/L
- 8-9 years: 21-28 mmol/L
- > or =10 years: 22-29 mmol/L
ANION GAP
- 12 ± 4 mEq/L (12 ± 4 mmol/L SI units) if potassium not included
- 16 ± 4 mEq/L (16 ± 4 mmol/L SI units) if potassium is included
شاید این مطلب برای شما مفید باشد:
مقادیر بحرانی در آزمایشگاه های تشخیص طبی | Critical values in medical diagnosis laboratories
توجه: محدوده مرجع و واحد آزمایش وابسته به روش انجام و کیت می باشد و ممکن است در آزمایشگاه های مختلف متفاوت باشد. بنابراین توصیه می گردد که آزمایش ها ترجیحا در یک آزمایشگاه مورد بررسی قرار گیرد.
سوالات متداول
چگونه از نتایج آزمایش الکترولیت ها و شکاف آنیونی استفاده می شود؟
پانل الکترولیت برای شناسایی عدم تعادل الکترولیت، مایع یا pH (اسیدوز یا آلکالوز) استفاده می شود. اغلب به عنوان بخشی از یک معاینه بهداشتی معمول درخواست می شود. ممکن است به خودی خود یا به عنوان جزئی از پانل متابولیک پایه (BMP) یا پانل متابولیک جامع (CMP) درخواست شود. این پانل ها می توانند شامل آزمایش های دیگری مانند BUN، کراتینین و گلوکز باشند.
اندازه گیری الکترولیت ممکن است برای کمک به بررسی شرایطی که باعث عدم تعادل الکترولیت می شوند مانند کم آبی بدن، بیماری کلیوی، بیماری های ریوی یا بیماری های قلبی استفاده شود.
از آنجایی که عدم تعادل الکترولیت و اسید-باز می تواند در طیف گسترده ای از بیماری های حاد و مزمن وجود داشته باشد، پانل الکترولیت اغلب برای ارزیابی بیمارانی که در اتاق اورژانس به دنبال مراقبت های پزشکی هستند و همچنین بیماران بستری در بیمارستان استفاده می شود.
نتایج برای یک پانل الکترولیت همچنین ممکن است شامل یک محاسبه برای شکاف آنیون باشد که می تواند برای کمک به تشخیص اختلالات یا وجود مواد سمی مورد استفاده قرار گیرد.
اگر عدم تعادل یک الکترولیت منفرد مانند سدیم یا پتاسیم دارید، پزشک ممکن است آزمایش مجدد آن الکترولیت را درخواست کند و عدم تعادل را تا زمانی که برطرف شود کنترل کند. اگر دچار عدم تعادل اسید و باز هستید، پزشک ممکن است آزمایشهایی را برای گازهای خونی که pH و سطح اکسیژن و دیاکسید کربن را در نمونه خون شریانی اندازهگیری میکند، برای کمک به ارزیابی شدت عدم تعادل و مانیتور پاسخ آن به خون درخواست کند.
چه زمانی آزمایش الکترولیت ها و شکاف آنیونی درخواست می شود؟
طبق توصیه پزشک شما، ممکن است یک پنل الکترولیت به عنوان بخشی از یک چک آپ معمولی درخواست شود. همچنین ممکن است به عنوان یک کمک تشخیصی در صورت داشتن علائم و نشانههایی مانند:
- تجمع مایعات (ادم)
- حالت تهوع یا استفراغ
- ضعف
- گیجی
- ضربان قلب نامنظم (آریتمی قلبی)
آزمایشهای الکترولیت معمولاً در فواصل منظم برای پایش درمان برخی بیماریها از جمله فشار خون بالا (فشار خون بالا)، نارسایی قلبی، بیماریهای ریوی، بیماریهای کبدی و بیماری کلیوی درخواست میشوند.
نتیجه آزمایش الکترولیت ها و شکاف آنیونی چه چیزی را نشان می دهد؟
سطوح بالا یا پایین الکترولیت می تواند ناشی از شرایط و بیماری های مختلفی باشد. به طور کلی، میزان مصرف الکترولیت در رژیم غذایی و جذب آن در بدن، میزان آب موجود در بدن و میزان دفع شده توسط کلیه ها بر سطوح الکترولیت ها تأثیر می گذارد. سطح الکترولیت ها نیز تحت تأثیر برخی هورمون ها مانند آلدوسترون است که سدیم را حفظ می کند و باعث دفع پتاسیم می شود و پپتیدهای ناتریورتیک، که باعث افزایش دفع سدیم توسط کلیه ها می شوند.
سطوح الکترولیت می تواند تحت تأثیر تغییرات مقدار آب در بدن شما قرار گیرد. مثلا:
- اگر کلیه های شما به درستی کار نمی کنند (به عنوان مثال، بیماری کلیوی)، ممکن است مایعات اضافی را در خود نگه دارید. این منجر به اثر رقیق شدن سدیم و کلرید می شود به طوری که آنها به زیر سطح نرمال می رسند.
- از سوی دیگر، اگر از دست دادن شدید مایعات (کم آبی) را تجربه کنید، ممکن است سطح پتاسیم، سدیم و کلر را افزایش دهید.
برخی از شرایط مانند بیماری قلبی و دیابت نیز ممکن است بر تعادل مایعات و الکترولیت ها در بدن شما تأثیر بگذارد و باعث سطوح غیر طبیعی الکترولیت ها شود.
دانستن اینکه کدامیک از الکترولیت ها در تعادل نیستند می تواند به پزشک شما کمک کند تا علت اصلی را تعیین کند و برای بازگرداندن تعادل مناسب در مورد درمان تصمیم گیری کند. در صورت عدم درمان، عدم تعادل الکترولیت می تواند منجر به مشکلات مختلفی از جمله سرگیجه، گرفتگی عضلات، ضربان قلب نامنظم و احتمالاً مرگ شود.
یکی از نتایج پانل الکترولیت من کمی خارج از محدوده است. این به چه معنا می تواند باشد؟
نتایج پانل الکترولیت شما توسط پزشک در چارچوب سایر آزمایش های که انجام داده اید و همچنین عوامل دیگری مانند سابقه پزشکی شما تفسیر می شود. یک نتیجه منفرد که کمی بالا یا پایین باشد ممکن است اهمیت پزشکی داشته باشد یا نداشته باشد.
دلیل اینکه چرا نتیجه آزمایش در روزهای مختلف متفاوت است و اینکه چرا خارج از محدوده مرجع تعیین شده قرار می گیرد، می تواند به خاطر موارد زیر باشد:
- تنوع بیولوژیکی (نتایج مختلف در یک فرد در زمانهای مختلف): اگر یک پزشک یک آزمایش مشابه را در چندین موقعیت مختلف روی شما انجام دهد، احتمال زیادی وجود دارد که یک نتیجه از محدوده مرجع خارج شود، حتی اگر از سلامت خوبی برخوردار باشید.به دلایل بیولوژیکی، نتایج شما می تواند از روزی به روز دیگر متفاوت باشد.
- تنوع فردی (تفاوت در نتایج بین افراد مختلف): محدوده مراجع معمولاً با جمع آوری نتایج از یک جمعیت بزرگ و تعیین داده ها از میانگین نتایج به دست می آید. افرادی هستند که سالم هستند اما نتایج آزمایش های آنها که برای شخص آنها طبیعی است، همیشه در محدوده مورد انتظار کل جمعیت قرار نمی گیرد.
بنابراین، یک نتیجه آزمایش که خارج از محدوده مرجع تعیین شده قرار می گیرد، ممکن است معنی خاصی نداشته باشد. به طور کلی، این مورد زمانی است که مقدار تست فقط کمی بالاتر یا کمتر از محدوده مرجع باشد و به همین دلیل است که یک پزشک ممکن است آزمایشی را روی شما تکرار کند.
با این حال، یک نتیجه خارج از محدوده ممکن است نشان دهنده یک مشکل باشد و مستلزم بررسی بیشتر باشد. پزشک شما نتایج آزمایش شما را در زمینه سابقه پزشکی، معاینه فیزیکی و سایر عوامل مرتبط ارزیابی میکند تا تعیین کند آیا نتیجهای که خارج از محدوده مرجع قرار میگیرد برای شما حائز اهمیت است یا خیر.
درمان عدم تعادل الکترولیت چیست؟
درمان بستگی به این دارد که کدام الکترولیت (ها) از تعادل خارج شده است و میزان آن تغییر چقدر است. درمان معمولاً شامل شناسایی علت(های) زمینه ای عدم تعادل و ارائه هر گونه حمایت لازم برای فرد آسیب دیده است.
مطالب مرتبط در متااورگانون:
شاید این مطلب برای شما مفید باشد:
آزمایش سدیم (Na)
شاید این مطلب برای شما مفید باشد:
آزمایش پتاسیم (+K) | Potassium
شاید این مطلب برای شما مفید باشد:
آزمایش کلرید (Cl) | آزمایش کلر | Chloride | کلراید
شاید این مطلب برای شما مفید باشد:
آزمایش بی کربنات (CO2 کل) | -HCO3
شاید این مطلب برای شما مفید باشد:
آزمایش گازهای خون | گاز خون شریانی | گاز خون وریدی
شاید این مطلب برای شما مفید باشد:
اسمولالیته (Osmolality) | شکاف اسمولال (Osmolal Gap)
شاید این مطلب برای شما مفید باشد:
آزمایش کراتینین (Cr) | Creatinine | کراتینین ادرار
شاید این مطلب برای شما مفید باشد:
آزمایش کلسیم (Calcium) | کلسیم کل | کلسیم یونیزه
شاید این مطلب برای شما مفید باشد:
آزمایش منیزیم | Magnesium Test | Mg
شاید این مطلب برای شما مفید باشد:
آزمایش فسفر | فسفات | فسفات معدنی
شاید این مطلب برای شما مفید باشد:
آزمایش ایمونوگلوبولین (Immunoglobulins IgA, IgG, IgM, IgE, IgD)
در جای دیگر وب:
منابع مقاله
2019 review performed by Kenneth A. Wong, BSc (MLS), MLT, Instructor, NAIT and the Editorial Review Board
Rifai, N. Tietz Textbook of Clinical Chemistry and Molecular Diagnostics. [Pageburstls]. Retrieved from https://pageburstls.elsevier.com/#/books/9780323359214/
Larson, D. Clinical Chemistry: Fundamentals and Laboratory Techniques. [Pageburstls]. Retrieved from https://pageburstls.elsevier.com/#/books/9781455742141/
Lewis J, Water and Sodium Balance, Merck Manual. Available online at https://www.merckmanuals.com/en-ca/professional/endocrine-and-metabolic-disorders/fluid-metabolism/water-and-sodium-balance. Accessed 7/17/19
Electrolyte Disorders. Merck Manual. Available online at https://www.merckmanuals.com/en-ca/professional/endocrine-and-metabolic-disorders/electrolyte-disorders. Accessed 7/17/19
Pagana, Kathleen D. & Pagana, Timothy J. (2001). Mosby’s Diagnostic and Laboratory Test Reference 5th Edition: Mosby, Inc., Saint Louis, MO
(2003) Anion Gap. Michigan State Univ, Dept of Physiology [On-line information for class 442]. Available online: at http://www.psl.msu.edu/class/442/anion_gap.htm.
(1995-2004). Chapter 59. Disorders of Acid-Base Metabolism. The Merck Manual of Geriatrics [On-line information]. Available online at http://www.merck.com/mrkshared/mm_geriatrics/sec8/ch59.jsp
(1995-2004). Acid-Base Metabolism. The Merck Manual of Diagnosis and Therapy, Section 2. Endocrine And Metabolic Disorders, Chapter 12. Water, Electrolyte, Mineral, And Acid-Base Metabolism [On-line information]. Available online at http://www.merck.com/mrkshared/mmanual/section2/chapter12/12g.jsp
Hornick, D., Editor (2003, Revised). An Approach to the Analysis of Arterial Blood Gases and Acid-Base Disorders. Virtual Hospital, University of Iowa Health Care [On-line information]. Available online at http://www.vh.org/adult/provider/internalmedicine/bloodgases/
Priestley, M. and Lieh-Lai, M. (2004 March 8, Updated). Excerpt from Acidosis, Metabolic. EMedicine [On-line information]. Available online at http://www.emedicine.com/ped/byname/acidosis-metabolic.htm
Jones, J. and Bosker, G. (2002 December 16) Diagnostic Aids in Emergency Medicine. The Emergency Medicine Reports Textbook of Adult and Pediatric Emergency Medicine [Excerpt from On-line Clinical Textbook]. Available online at http://www.thrombosis-consult.com/articles/Textbook/146_diagnosticaids.htm and http://www.thrombosis-consult.com/ClinicalTextbooks2.htm
Beaven, A. (2002 July 12). Ethylene Glycol and Methanol Toxicity. Univ of NC at Chapel Hill, Department of Internal Medicine [On-line information]. PDF available for download at http://www.med.unc.edu/medicine/web/ethyleneglycol.pdf
(2002). Acid-Base Emergencies, Part 1. Texas Society for Respiratory Care [On-line information]. Available online at http://www.tsrc.org/cert005/
Ben-Joseph, E., Reviewed (2004 July). Dehydration. Familydoctor.org Information for Parents [On-line information]. Available online at http://www.kidshealth.org/PageManager.jsp?dn=familydoctor&lic=44&article_set=21646
Webner, D., Updated (2003 August 18). CO2. MedlinePlus Medical Encyclopedia [On-line information]. Available online at http://www.nlm.nih.gov/medlineplus/ency/article/003469.htm
A.D.A.M. editorial, Updated (2003 October 15). Electrolytes. MedlinePlus Medical Encyclopedia [On-line information]. Available online at http://www.nlm.nih.gov/medlineplus/ency/article/002350.htm
Clarke, W. and Dufour, D. R., Editors (2006). Contemporary Practice in Clinical Chemistry. AACC Press, Washington, DC. Pp 333-33
Henry’s Clinical Diagnosis and Management by Laboratory Methods. 21st ed. McPherson R, Pincus M, eds. Philadelphia, PA: Saunders Elsevier: 2007
ARUP Lab Tests. Electrolyte Panel. Available online at http://www.aruplab.com/guides/ug/tests/0020410.jsp. Accessed September 2011.
Mayo Medical Laboratories. 87972 Overview: Electrolyte Panel, Serum. Available online at http://www.mayomedicallaboratories.com/test-catalog/print.php?unit_code=87972. Accessed September 2011.
Ambalavanan, N. (2014 February 28, Updated). Fluid, Electrolyte, and Nutrition Management of the Newborn. Medscape Drugs & Diseases [On-line information]. Available online at http://emedicine.medscape.com/article/976386-overview#showall. Accessed October 2015.
Genzen, J. and Lehman, C. (2015 April, Updated). Electrolyte Abnormalities, Life Threatening. ARUP Consult [On-line information]. Available online at http://www.arupconsult.com/Topics/ElectrolyteAbnormalities.html. Accessed October 2015.
Byrd, R. and Roy, T. (2015 July 31, Updated). Respiratory Acidosis. Medscape Drugs & Diseases [On-line information]. Available online at http://emedicine.medscape.com/article/301574-overview. Accessed October 2015
Dugdale, D. (2013 August 3, Updated). Electrolytes. MedlinePlus Medical Encyclopedia [On-line information]. Available online at http://www.nlm.nih.gov/medlineplus/ency/article/002350.htm. Accessed October 2015
Wisse, B. (2013 November 7, Updated). Alkalosis. MedlinePlus Medical Encyclopedia [On-line information]. Available online at http://www.nlm.nih.gov/medlineplus/ency/article/001183.htm. Accessed October 2015
Dugdale, D. (2013 October 29, Updated). Metabolic acidosis. MedlinePlus Medical Encyclopedia [On-line information]. Available online at http://www.nlm.nih.gov/medlineplus/ency/article/000335.htm. Accessed October 2015
(© 1995–2015). Electrolyte Panel, Serum. Mayo Clinic Mayo Medical Laboratories [On-line information]. Available online at http://www.mayomedicallaboratories.com/test-catalog/Overview/87972. Accessed October 2015