الگوریتم تشخیصی ژن CYP2D6 | سیتوکروم P450
الگوریتم تشخیصی ژن CYP2D6:
ژن CYP2D6 عضوی از ابرخانواده آنزیم های سیتوکروم P450 را کد می کند. پروتئینهای سیتوکروم P450 مونواکسیژنازهایی هستند که بسیاری از واکنشهای دخیل در متابولیسم دارو و سنتز کلسترول، استروئیدها و سایر چربیها را کاتالیز میکنند. این پروتئین در شبکه آندوپلاسمی لوکالیزه و جمع می شود و به عنوان متابولیزه کننده 25 درصد از داروهای رایج شناخته شده است.
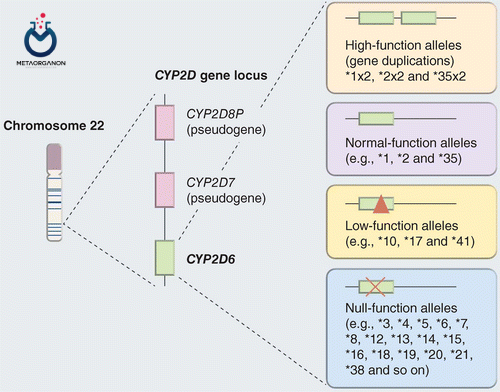
سوبستراهای آن شامل داروهای ضد افسردگی، ضد روان پریشی، مسکن ها و ضدسرفه ها، داروهای مسدودکننده بتا آدرنرژیک، ضد آریتمی و ضد استفراغ است. این ژن در جمعیت انسانی بسیار پلی مورفیسم و چندشکل است، تاکنون بیش از 70 نوع آللی آن شرح داده شده است. از این تعداد، بیش از 15 مورد آنزیم غیرفعال یا بدون آنزیم را رمزگذاری می کنند. آلل های خاص منجر به فنوتیپ متابولیزه کنندگی ضعیف می شوند که با کاهش توانایی متابولیزه کردن سوبستراهای آنزیم مشخص می شود.
پلی مورفیسم ژن CYP2D6
برخی از افراد با فنوتیپ متابولیسم ضعیف فاقد پروتئین عملکردی هستند زیرا حامل 2 آلل فاقد عملکرد هستند در حالی که در افراد دیگر این ژن وجود ندارد. این ژن می تواند از نظر تعداد کپی متفاوت باشد و افراد با فنوتیپ متابولیزور فوق سریع می توانند 3 نسخه یا بیشتر از ژن فعال داشته باشند. به طور متناوب انواع رونوشت متصل شده که ایزوفرم های مختلف را کد می کنند برای این ژن یافت شده است.
جایگاه ژنی CYP2D6
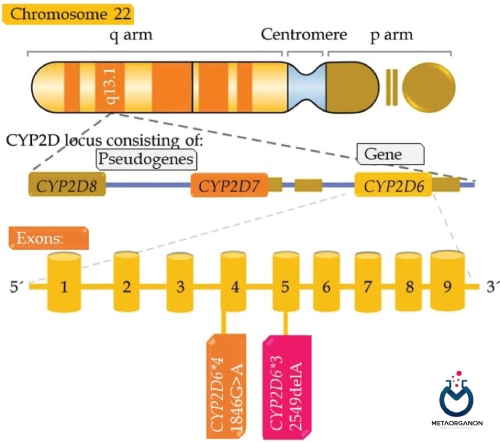
بسیاری از داروها، به ویژه ترکیبات چربی دوست مانند روانگردان ها باید قبل از دفع در ادرار متابولیزه شوند. متابولیسم اکسیداتیو فاز I که توسط آنزیم های سیتوکروم P450 (CYP) کاتالیز می شود، نقش عمده ای در این زمینه ایفا می کند. ژن کد کننده آنزیم CYP2D6 روی کروموزوم 22 قرار دارد.

برخی از داروهایی که متابولیسم آنها توسط CYP2D6 کاتالیز می شود.
در دهه 1960 نشان داده شد که تغییر 30 تا 40 برابری در غلظت پلاسمایی نورتریپتیلین ضد افسردگی سه حلقه ای در بیمارانی که با همان دوز درمان شده اند به دلیل تغییر شدید در سرعت متابولیسم دارو است. مطالعات دوقلو بیشتر نشان داد که سرعت متابولیسم دارای یک جزء ژنتیکی قوی است و در سال 1980 نشان داده شد که 10-هیدروکسیلاسیون نورتریپتیلین توسط دبریزوکین/اسپارتئین هیدروکسیلاز چندشکل (CYP2D6) کاتالیز می شود.

مهارکننده های CYP2D6
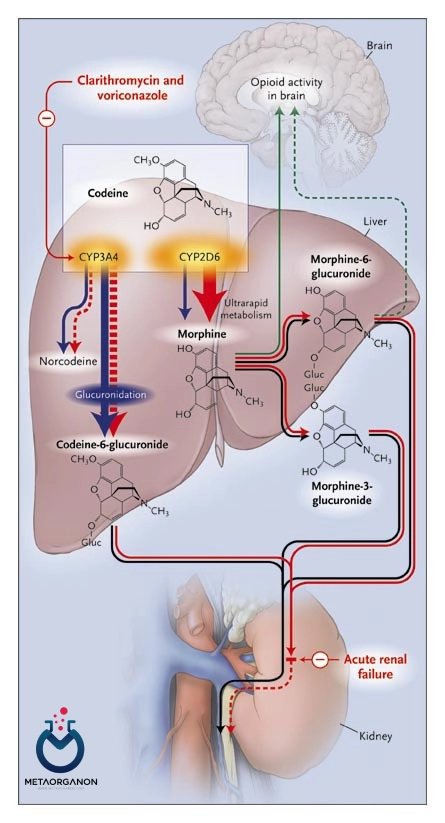
CYP2D6 عمدتاً در کبد بیان می شود، و اگرچه این آنزیم تقریباً 3٪ از محتوای CYP کبدی را نشان می دهد، حدود 20٪ از داروها را متابولیزه می کند. تنوع زیادی در محتوای CYP2D6 کبد وجود دارد که در برخی افراد پروتئین وجود ندارد. در میان آنزیمهای CYP، CYP2D6 به دلیل ناتوانی نسبی خود در القای قرار گرفتن در معرض اگزوبیوتیک ها متمایز است. مهار بالینی قابل توجه CYP2D6 که منجر به کاهش متابولیسم داروهای سوبسترا می شود با درمان همزمان با کینیدین، سیناکلست و مهارکننده های بازجذب سروتونین رخ می دهد.
نحوه عملکرد CYP2D6
تا حد زیادی عامل اصلی تعیین کننده فعالیت و بیان CYP2D6 در کبد، عوامل ژنتیکی است. در واقع، فارماکوژنتیک CYP2D6 دارای تاریخچه طولانی است که از دهه 1960 با توصیف کنترل ژنتیکی سطوح پلاسمایی نورتریپتیلین و کشف کمبودهای ارثی در متابولیسم دبریزوکین و اسپارتئین و نهایتاً مکانیسم های مولکولی بروز میکند.
بیش از 100 آلل مستند CYP2D6 وجود دارد که تعدادی از انواع آن در قومیت های مختلف رایج تر است. CYP2D6∗6 (عملکرد صفر، انحراف اتصال) در یک نفر از هر چهار قفقازی رخ می دهد و علت اصلی متابولیسم ضعیف CYP2D6 است. در آسیاییها، CYP2D6∗10 (کاهش فعالیت، چندشکلی غیرمترادف) و CYP2D6∗41 (کاهش بیان، SNP درونی که باعث اتصال نابجا میشود) به ترتیب در 50% و 10% از این جمعیت یافت میشوند. علاوه بر این، CYP2D6∗17 (کاهش فعالیت، چندشکلی غیر مترادف) در 30٪ از آفریقایی ها وجود دارد. حذف ژن CYP2D6 (CYP2D6∗5) در 5 درصد از کل جمعیت ها وجود دارد.
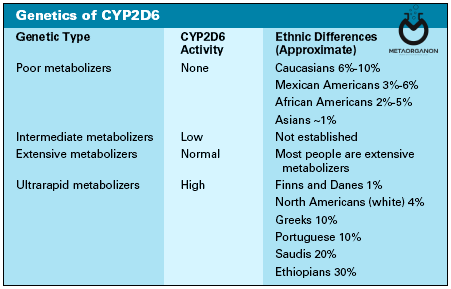
آلل CYP2D6 در قومیت های مختلف
تکثیر ژن CYP2D6 (تا 13 نسخه) برای آلل های عملکردی و غیرعملکردی با فنوتیپ متابولیزه کننده فوق سریع به ویژه در آفریقایی ها توصیف شده است. چنین روابط پیچیده ژنوتیپ-فنوتیپ CYP2D6 در میان جمعیتهای مختلف، یک رویکرد پزشکی شخصیسازی شده را برای تنظیم دارو درمانی داروهای بستر CYP2D6 به جای یک رویکرد چالشبرانگیز ارائه کرده است.
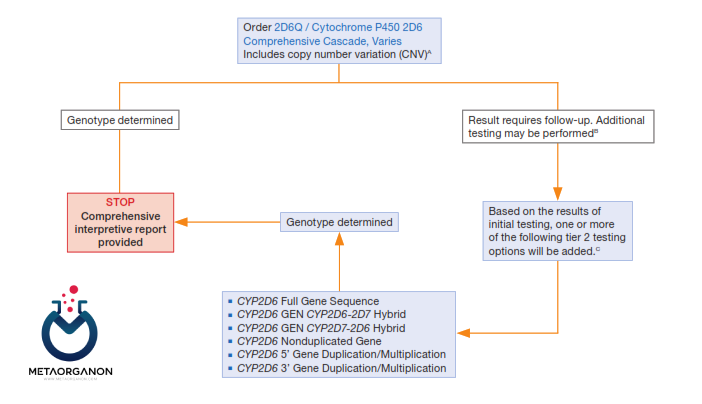
الگوریتم تشخیصی ژن CYP2D6
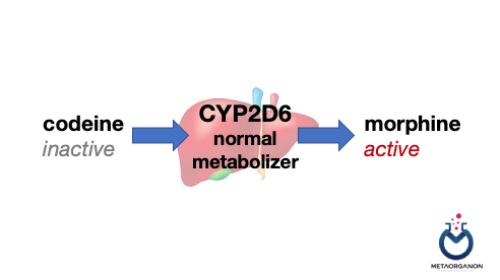
گزارش شده است که دوز دارو، پاسخ، و خطر سمیت بتا بلوکرها و داروهای ضد افسردگی به شدت به فارماکوژنتیک CYP2D6 وابسته است. علاوه بر این، فعالسازی زیستی کدئین به مورفین به CYP2D6 نیاز دارد که منجر به گزارشهایی درباره تأثیر ژنتیکی ایمنی دارو میشود.
در سایت frontiers در مورد این تست بیشتر بخوانید:
تفاوت های ژنتیکی در متابولیسم سیتوکروم P450 (CYP) برای چندین دهه شناخته شده است. از نظر بالینی مهم ترین آنزیم چند شکلی CYP2D6 است که نقش کلیدی در متابولیسم بسیاری از داروهای ضد افسردگی و ضد روان پریشی، همراه با طیف وسیعی از داروهای غیر روانپزشکی ایفا می کند. فردی کردن دوز بر اساس ژنوتیپ CYP2D6 برای بهبود اثر و ایمنی درمان دارویی برای مدت طولانی یک جاه طلبی بوده است. استفاده بالینی از ژنوتیپ CYP2D6 به طور پیوسته در حال افزایش است. با این حال، برای موفقیت ژنوتیپ پیشگیرانه در پیش بینی نیازهای دوز فردی، دقت بالایی از ترجمه ژنوتیپ به فنوتیپ مورد نیاز است.












